CAR-T细胞治疗新基因面世,耶鲁团队研发“密集平行基因敲入”技术,可将数十种结构物敲入T细胞受体位
目前,在免疫学基础研究、以及免疫细胞治疗上,免疫细胞的基因编辑工具都起着极大的作用。过继性细胞治疗,是近十年来兴起的新型肿瘤免疫治疗手段,并呈现出快速发展的趋势。
截止目前,已有 6 款第二代 CAR-T 细胞治疗产品被美国食品药品监督管理局批准用于治疗 B 细胞白血病和多发性骨髓瘤,目前已有多位病人获得不同程序的治疗效果。
CAR-T 细胞治疗让肿瘤病人的治愈成为可能。但是,面对当下高发的实体瘤,这种疗法依旧束手无策。主要原因在于,T 细胞很难浸润到实体瘤中。而且在实体瘤的免疫抑制环境中,CAR-T 细胞很容易被耗竭,以至于无法产生持续性的治疗效果。
要想突破这些瓶颈,对于改造后的 CAR-T 细胞,进行无偏差的大规模筛选是一种快速高效的途径。
然而,当下很难直接在人类原代 T 细胞上进行筛选。原因在于,原代 T 细胞的自我免疫排斥机制、以及有限的生命周期,导致病毒感染效率非常低且不稳定。
目前常用的基因编辑系统递送工具,主要依赖重组病毒比如慢病毒和腺病毒等。但是,这些病毒是以随机整合的模式,将外源基因整合到目标细胞基因组当中,因此存在插入诱变和翻译沉默的风险。并且,当整合的拷贝数量不一时,会给整个筛选带来极大的背景干扰。
因此,对于免疫细胞筛选来讲,精准的基因编辑至关重要。当前,已有实验室研发了将 Cas9RNP 和 dsDNA/ssDNA 相结合的非病毒精准基因编辑方法。
但是,由于电转 DNA 会对细胞产生严重的细胞毒性,这限制了其在 T 细胞中敲入基因文库的规模,导致这种基因筛选方法通常只能做出单一的修饰。
01
耶鲁团队推出“密集平行基因敲入”新技术
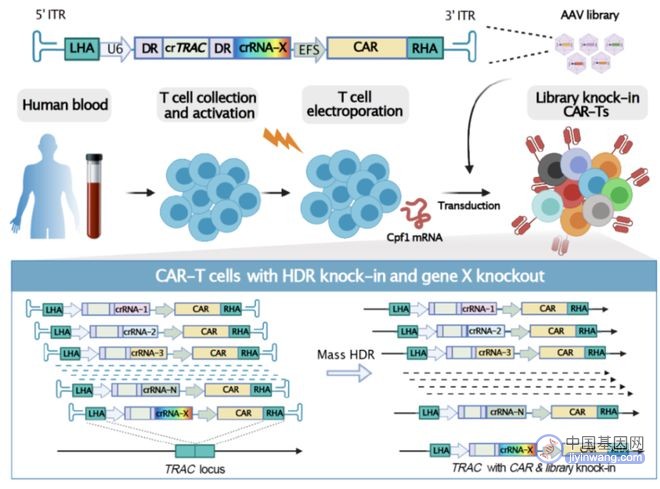
为了对 T 细胞实现更好的大规模筛选,耶鲁大学教授课题组研发出一款名为“密集平行基因敲入”的新技术(CLASH),这是一种基于 CRISPR 基因编辑与腺相关病毒库介导的密集平行同源重组基因敲入技术。
(来源:Nature Biotechnology)
该技术结合了信使核糖核酸(mRNA)、以及腺相关病毒(Adeno-Associated Virus,AAV)文库。经过 mRNA 编码之后的 CRISPR Cpf1/Cas12a 剪切酶,利用单条的 crRNA 阵列就能达到多基因剪切的效果。
而且,Cpf1 剪切后形成的粘附末端,更有利于同源重组。所以,将它与载有文库和同源重组模版的腺相关病毒相结合,就能对 T 细胞进行大规模长链转基因的精准敲入和多基因的敲除。
相比传统的以 DNA 为模版的长链转基因敲入方法,CLASH 平台产生的细胞毒性更低,导入的文库量更大、且灵活性更高。
为了证明 CLASH 平台的可行性,该团队设计了 Cpf1crRNA 文库,并在多个模型中寻找可以提高细胞治疗可持续性的相关靶点。
在后期数据分析当中,他们不仅发现了已被临床证实可以提高 CAR-T 持久性的 TET2 基因,也发现了多个潜在新靶点。
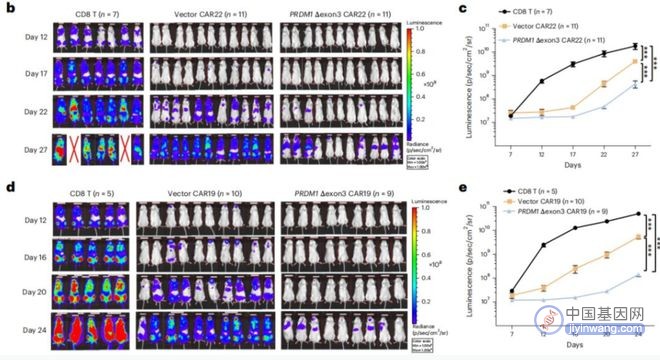
而且,其还在这些靶点中发现了⼀个可以靶向 PRDM1 的 crRNA, 它能在基因组当中发生选择性剪切,从而产生特异的外显子 3 跳跃的突变体 PRDM1Δexon3。
Exon3 的缺失,会破坏 PRDM1 蛋白的 PR domain。但是,对于这个转录因子的具体 PR domain 功能,课题组尚不清楚。
在其他研究团队的帮助下,该实验室通过肽段点阵分析,发现 exon3 缺失的 PRDM1 蛋白,丧失了与组蛋白 H4 的直接结合能力,进而对下游基因失去了调控能力。
此外,他们结合染色质免疫共沉淀测序⽅法和结合转录组分析方法,从全基因组层面揭示了PRDM1 Δexon3 CAR-Ts 的直接调控机制。
结果发现,PRDM1 Δexon3 CAR-Ts 不仅显示出了 T 细胞干性, 并且具有更强的细胞增殖能力,因此在多个体内模型当中都展现出更好的抗肿瘤能力和在体内的持久性。
近日,相关论文以《人类 T 细胞的大规模并行敲入工程》()为题发在 Nature Biotechnology 上[1]。

图 | 相关论文(来源:Nature Biotechnology)
总体来看,在基因编辑和免疫治疗的论文里,在实验设计、筛选和靶向基因验证等方面,该成果都展现出了较高的水平。
目前,T 细胞功能的 CRISPR 筛选平台大多基于随机集成系统,存在插入突变的潜在风险。然而,CLASH 技术能将多种合成基因片段靶向,借此敲入 T 细胞受体位点,从而实现⾼效率和低细胞毒性的高通量 CRISPR 筛选。总的来说,与现有的 CRISPR 筛选 T 细胞治疗技术相比,CLASH 有着重大进步。
据介绍,本次工作侧重于通过测试密集平行敲入 Cpf1 crRNA 文库和长链 CAR 转基因,来构建大量 CAR-T 细胞的突变体,在筛选之后来寻找提高过继性细胞治疗效果的靶点。在体内外的模型中,CLASH 的可行性、灵活性和高效性均得以验证。
未来,CLASH 筛选平台有望产生更广泛的应用:在本次研究中,文库的量约为八千。但是在测试敲入效率之后,该团队通过计算发现,理论上 CLASH 能被轻松用于全基因组的单基因敲除筛选以及激活筛选。
而且,由于 Cpf1 可以用单链 crRNA 进行多基因剪切,因此理论上 CLASH 也能用于双基因敲除筛选。除了 CRISPR/Cpf1 文库外,CLASH 也能改变长链转基因。这样一来,合成的 CAR-T 基因能被改变成 T 细胞受体库或其他合成库,从而用于大规模的转基因筛选。
鉴于在腺相关病毒载体里可以对同源臂进行重设计,因此 CLASH 也可用于测试不同整合位点对转基因库的调控作用。
未来,预计经过一定的优化,CLASH 原则上还能用于许多其他原代细胞、免疫细胞、干细胞或来自其他物种的细胞。
总之,研究人员相信 CLASH 会拥有广泛的应用前景,将为免疫细胞或其他原代细胞的基础研究和临床转化,提供强大新手段和新思路。
02
900 个人源基因,文库总量约为 8000
据介绍,早在 2017 年课题组便开始着手本次课题。最初,他们主要聚焦在如何将 CRISPR 系统应用到人类原代 T 细胞里。
当时,T 细胞的转基因递送工具主要依赖重组慢病毒或腺病毒。因此,该团队多次尝试把 CRISPR 的编辑系统,以慢病毒的方式递送到人类 T 细胞当中。
然而,由于 CRISPR 剪切酶 spCas9 太大(约 4.1kb),被包裹进慢病毒的效率太低,这样一来包裹出来的病毒滴度就很低。
加上原代 T 细胞感染效率本身就比其他细胞系低很多,因此不管使用 All-In-One 的慢病毒体系,还是将 spCas9 和 guide RNA 分为两部分的双慢病毒体感染体系,都不能达到很好的感染效果。
这时,课题组只能选择另辟蹊径。后来,他们发现 Cpf1 mRNA 和腺相关病毒 6 的组合,不仅可以高效且模块化地修改 T 细胞,还能将研究团队想要的转基因比如 guide RNA 和 CAR 整合到基因组当中。
而且,相比此前通过使用 Cas9RNP 和 ssDNA/dsDNA 去改造 T 细胞的方法,他们使用的方法毒性更低。关于这一成果,该团队已于 2019 年将论文发表在 Nature Methods 上。
接下来,便是文库的敲入。在成功建立腺相关病毒-Cpf1 KIKO 体系之后,要解决的问题便是能否成功将大量文库整合到 T 细胞当中。
在做高通量筛选时,对于后面的筛选和分析,初始文库的覆盖率起到了至关重要的作用。
因此,课题组选择 900 个免疫相关的人源基因,为每个基因设计了 8 个 Cpf1 crRNA,最终的文库总量约为 8000。在对整合后的 CAR-T 细胞进行深度测序时,他们发现 guide RNA 的覆盖率大于 98%。由此他们推算,如果增加初始电转细胞数量,还可以用更大的文库做筛选。
接下来便是建立 T 细胞耗竭的体内外模型。筛选平台的建立主要为了解决 CAR-T 在临床中遇到的问题。在当前的细胞治疗中,无论是液态瘤还是实体瘤,CAR-T 细胞在体内的持久性,都是临床判断治疗效果的主要指标。
但是,在体内抗原的持续刺激之下,T 细胞非常容易耗竭,故会导致肿瘤的复发。因此,为了模仿这种因为抗原持续刺激而导致的 CAR-T 细胞耗竭的状态,课题组建立了 CAR-T 细胞和癌细胞的体外长时间共培养模型、体内的血液流模型、以及实体瘤模型。
筛选之后,他们发现 CD4 和 CD8 CAR-T 文库组中幸存下的 CAR-T 细胞,更加具有干细胞特性。
然后,便是阳性靶点的呈现。迄今为止,人们在临床中只发现了少数能增强 CAR-T 细胞体内可持续性的靶点比如 TET2 基因。而 TET2 基因也出现在该团队所有的筛选模型的 top hits 中,这无疑进一步证实了 CLASH 筛选平台和 T 细胞耗竭模型的可行性。
最后一步则要验证所筛选靶点。研究中,该团队找到了几个共享靶点。做完初步验证之后,他们选取其中一个最有潜力的候选基因 PRDM1,将其在体内体外模型上做了详细验证。
结果发现,不管是在体外模型还是体内模型中,PRDM1 三号外显子突变 CAR-T,都显示出更好的持续性以及抗肿瘤能力。
(来源:Nature Biotechnology)
03
力争开发新型细胞治疗候选药物
事实上, 作为体内和体外的表达转基因递送工具,腺相关病毒已经被广泛使用。
在不同细胞和组织中,不同亚型的腺相关病毒存在不同程度的表达。研究中,本文论文第一作者博士发现:在 T 细胞中,腺相关病毒 6 直接递送的、由 EFS 调控的转基因,在没有被整合到基因组之前,它的功能基本是“沉默”的。
只有当腺相关病毒 6 的 MOI 大于 105 才会产生很弱的翻译,而这一结果和其他团队的研究结果是一致的[2]。同时,该团队对携带相同转基因的腺相关病毒 6 在癌细胞系里的表达情况,进行了平行测试,结果发现转基因的表达水平非常高。
因此在 T 细胞里,对于腺相关病毒基因组 DNA 来说,在整合前和整合后的转基因表达调控,是一个非常有意思的问题。
后续,课题组将进一步提高 CLASH 的优势和应用性,以让其成为更完美的细胞工程研发工具,同时也将在其他方向上更好地借助 CLASH 去扩展新的科学发现。在临床转化上,该团队将把一部分新技术和新发现,推向临床转化研究,以期开发新型细胞治疗候选药物,从而更好地造福病人。
参考资料
1.Dai, X., Park, J.J., Du, Y. et al. Massively parallel knock-in engineering of human T cells. Nat Biotechnol (2023). https://doi.org/10.1038/s41587-022-01639-x
2.Eyquem J, Nature, 2017
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。