首款眼科基因治疗药物问世!眼科基因治疗的前世今生!
基因治疗是通过基因工程技术将目的基因导入靶细胞,通过调控、修复、替换、添加或删除遗传序列,以治疗或预防疾病的一种治疗方式。基因疗法在近20年间飞速发展,医学家们希望能够通过基因治疗治愈各种遗传疾病。如今,通过腺相关病毒(adeno-associated virus,AAV)作为载体将目的基因输送到视网膜、肝脏和神经系统,可分别实现先天性失明、B型血友病和脊髓性肌肉萎缩症患者临床症状的改善。

一
眼睛是基因治疗的理想靶器官
基因疗法能够为人类健康提供持久的益处,我们有理由继续保持乐观,并加大努力使基因疗法成为标准治疗的一部分,特别是眼科方面,在基因治疗领域具有明显的优势,发展也非常迅速(图1)。眼睛是基因治疗的一个理想靶器官。血视网膜屏障和血房水屏障2套血眼屏障的存在使得眼睛的免疫系统相对独立,作为部分免疫豁免器官,由于免疫反应被抑制,基因治疗的可行性更高。
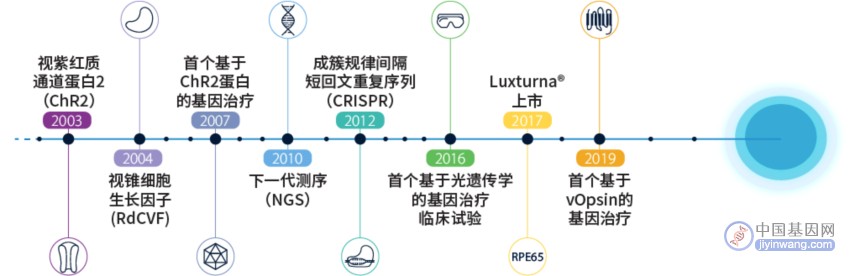
注:vOpsin是一种七重跨膜蛋白,属于G蛋白偶联受体家族(GPCRs),通常用于脊椎类动物视光学的研究。[Prog Retin Eye Res. 2022; 86: 100975.]
图1. 从发现基因突变到基因治疗的历史回顾
从研究角度而言,眼睛前部透明的结构允许通过无创的检查技术来评估视网膜的完整性和功能性,这也使视网膜成为了眼科基因治疗的主要靶向组织。这一特点不仅可以诊断和识别视网膜疾病,还可以评估治疗的有效性和安全性。根据靶细胞的不同,视网膜给药途径可以分为2种(图2-3)。
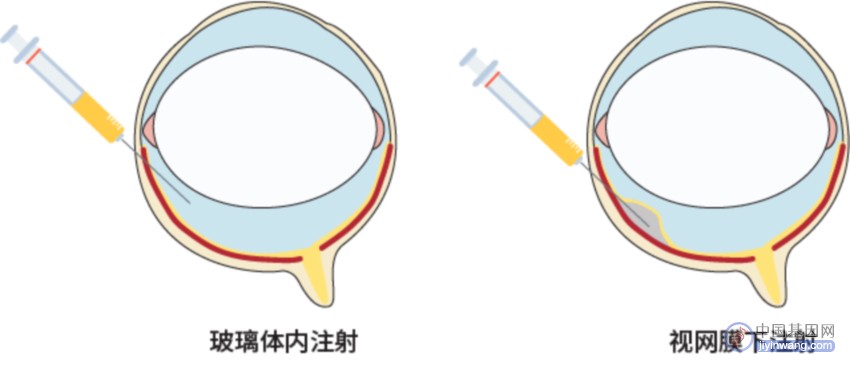
图2. 眼科基因治疗给药途径
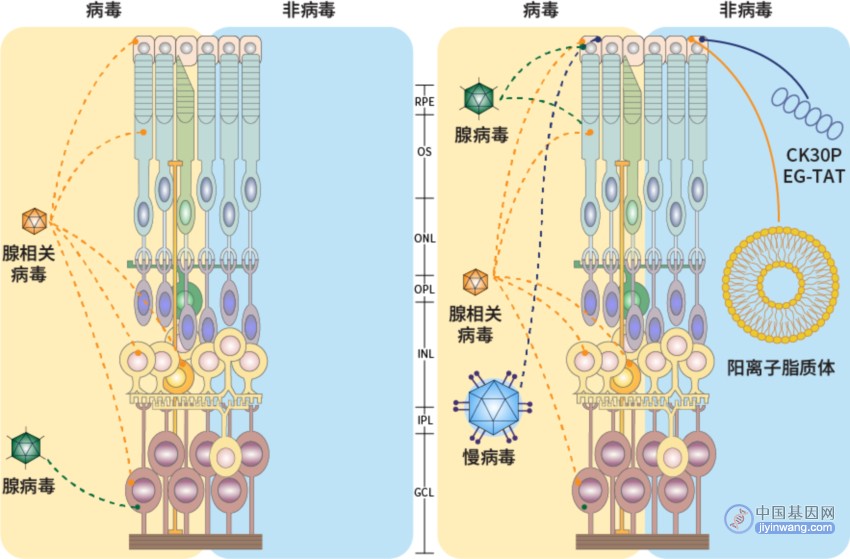
注:RPE:视网膜色素上皮层;OS:外感光层;ONL:外核层;OPL:外丛状层;INL:内核层;IPL:内丛状层;GCL:神经节细胞层。[Prog Retin Eye Res. 2022; 86: 100975.]
图3. 眼科基因治疗递送载体
当治疗的靶细胞为神经节细胞和内核层细胞时,首选玻璃体注射;当治疗光感受器或视网膜色素上皮的细胞时,首选视网膜下注射,后者的优点是注射部位在血视网膜屏障之后,但缺点是更具侵入性风险,需要进行视网膜剥离,并易在注射部位形成视网膜下出血。[Hum Gene Ther. 2022; 33(17-18): 865-878.]
二
首款眼科基因治疗药物问世
美国食品药品监督管理局(FDA)和欧洲药品管理局(EMA)在2017年和2018年之间批准了眼科的第一款基因治疗药物voretigene neparvovec(Luxturna®,Spark Therapeutics),用于治疗双拷贝RPE65基因突变导致的遗传性视网膜病疾病,RPE65基因负责编码将全反式视黄酯转化为11-顺式视黄醇的酶,这一过程是视网膜色素上皮内的视觉周期的一部分,当RPE65基因发生突变时,导致此类疾病会发展为法定失明,这也意味着基因治疗有可能会实现真正意义上的“重见光明”。
Voretigene neparvovec(VN)相关临床试验的1 - 2期确定了药物的安全性,且多数受试者视力改善大于15个字母;其3期临床试验结果是眼科基因治疗的首次随机对照试验,干预组20例患者的移动性测试表现均优于对照组9例患者,且其疗效在1年内保持稳定。也就是因为关键性的3期研究数据显示了患者的功能性视力改善具有统计学意义,使得Luxturna®成为了首款被批准的眼科基因治疗药物。[中华眼底病杂志, 2021, 37(11): 896-900.]
VN通过视网膜下注射的方式递送AAV载体中的人类RPE65基因的正确编码序列到视网膜色素上皮。基本操作如下:在玻璃体切割术后,通过一个小的注射套管达到视网膜并施加轻微压力,形成视网膜切口,注射液可以通过切口进去视网膜下空间,以完成治疗载体溶液的输送(图4)。VN治疗可以通过外科医生手动或控制脚踏板注射装置完成注射。患者每只眼接受1.5 x 1011个载体基因组的单次注射,预期目标体积为300 μL。
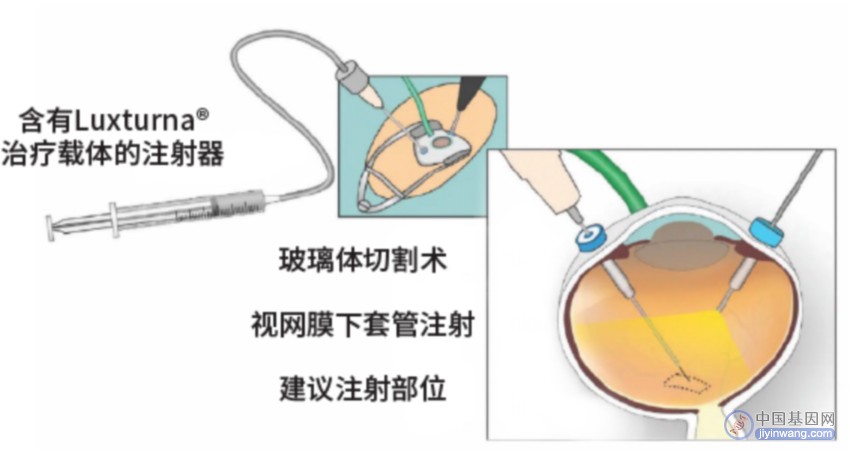
图4. Luxturna®基因治疗操作原则
(图源:ophthalmology times & LMU Eye Hospital)
注射后在视网膜下形成1个或多个充满液体的气泡(blebs)。这些气泡在视网膜下给药后24 - 48小时内被吸收。药物由受体介导被靶细胞视网膜色素上皮细胞所摄取吸收。一旦进入细胞核,单链DNA被转录成双链DNA,随后mRNA在细胞体中被翻译成功能性蛋白。
三
近期相关视网膜萎缩病例报告
诸如此类的新基因治疗为眼科无法治愈的疾病带来了希望,然而,与任何全新的治疗产品一样,新基因治疗的真实世界数据非常有限,因此关于药物持久性、安全性、以及效益风险比的不确定性自然是存在的。近期,关于术后出现视网膜萎缩的病例报告确实令人担忧。从长远来看,VN可能导致潜在的视网膜破坏性结果,也需要进一步研究来跟进基因治疗潜在的长期安全性问题。
在早期的临床研究中,也提示基因治疗存在一定的风险。但是绝大多数与治疗相关的不良事件是短暂和轻微的,包括眼压升高、白内障、眼部炎症、视网膜撕裂、小凹形成(dellen)、视网膜沉积等。视网膜下注射治疗的常见并发症包括:周边视网膜裂孔、继发性黄斑裂孔、视网膜出血和视网膜脱离。
2022年发布的一项研究报道:10名接受视网膜下注射VN的患者共有18只眼睛出现周围性脉络膜视网膜萎缩,10名患者中有8名(80%)出现了双侧眼萎缩。手术后平均4.7个月开始出现萎缩,且所有病例的萎缩范围逐渐扩大,平均随访期为11.3个月(4 - 18个月)。有10只眼睛(55.5%)在视网膜下注射区域(blebs区)的内侧和外侧发生了萎缩,7只眼睛(38.9%)仅在注射区域内发生,1只眼睛(5.5%)仅在注射外侧发生。尽管出现了萎缩,大多数患者的视功能仍保持稳定,甚至得到了改善。18只眼睛中有12只视力有所提高,3只没有变化,3只视力有下降。经统计学分析,术前和术后的平均视力没有明显变化(P=0.45)。[Ophthalmol Retina. 2022; 6(1): 58-64.]
今年的另一项研究也报道说,回顾性分析了8名接受视网膜下注射VN的患者,术后6 - 24个月有13只眼睛出现视网膜萎缩。所有患者都出现了注射区域内的萎缩,有3名患者在注射区域外出现了萎缩。萎缩的区域随着时间推移有所扩大,但患者的视功能结局(视力、视野)保持稳定。[Br J Ophthalmol. 2022; bjophthalmol-2021-321023.]
基因治疗视网膜下注射VN可导致视网膜萎缩,从而可能导致注射区域内外的光感受器丢失。但2篇近期的报道都显示,虽然萎缩区域也包括了中央区域,但治疗的功能益处没有受到影响,并且视功能保持相对稳定。基因治疗后出现视网膜萎缩的可能原因首先考虑免疫因素,针对载体基因组的免疫反应或针对外壳的免疫反应,也有可能与药物制造中掺入的相关杂质有关。
其次考虑手术因素,即由于注射部位机械性外力引起视网膜损伤而出现了应激反应。同时,RPE65基因相关的视网膜疾病患者的视网膜存在营养不良的变化,更脆弱的视网膜可能更容易受到损伤。
四
基因治疗需规范治疗以降低风险
2022年8月,中华医学会眼科学会眼底病学组发布了《中国遗传性视网膜疾病基因治疗手术安全性管理和视功能评价指标设定专家共识》,针对遗传性视网膜疾病基因治疗围手术期管理规范提出共识性意见(图5),供眼科及相关学科临床医师在临床实践中参考,以期规范治疗、降低风险,更好地保护患者利益。
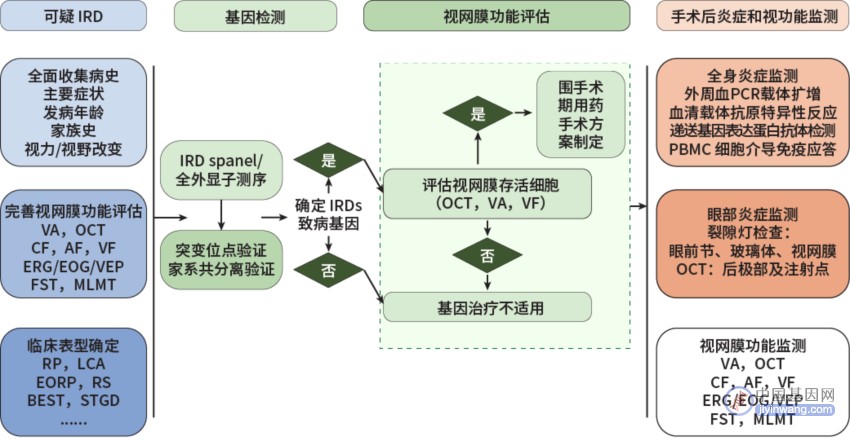
注:IRD:遗传性视网膜疾病;VA:视力;OCT:光相干断层扫描;CF:彩色眼底照相;AF:自身荧光;VF:视野;ERG:视网膜电图;EOG:眼电图;VEP:视觉诱发电位;FST:全视野光敏阈值测试;MLMT:多亮度移动性测试;RP:视网膜色素变性;LCA:Leber先天性黑矇;EORP:早发型RP;RS:先天性视网膜劈裂症;BEST:BEST卵黄样黄斑营养不良;STGD:青少年黄斑营养不良;PCR:聚合酶链反应;PBMC:外周血单核细胞。[中华眼底病杂志, 2022, 38(8): 636-642.]
图5. IRD基因治疗围手术期管理流程图
总结
眼科基因治疗的治疗例数是很有限的,目前真实世界数据不足,尚不足以对术后视网膜萎缩发展的原因及其长期视功能的影响得出明确的结论,但规范基因治疗相关研究中的手术操作以及对所有患者进行长期随访是非常重要的,后者可使医生对治疗可能产生的长期影响有更准确的了解。这对未来患者的选择有重要意义,并有助于预测符合条件的患者的预期治疗效果。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。