Leukemia:纳米颗粒递送siRNA靶向融合基因治疗儿童急髓白血病
染色体异位形成融合基因以及融合基因表达是儿童、青少年和年轻成人(adolescent and young adult,AYA)急性髓系白血病(AML)的一大特征,例如最常见的染色体异位t(8;21)(q22:q22),其发生于10%-15%的儿童和AYA AML,并且产生RUNX1/ETO融合基因。RUNX1/ETO融合蛋白下调依赖RUNX1的转录组,来驱动白血病细胞的自我更新,阻止髓系细胞的分化,因此它是潜在的治疗靶点。然而,用传统的药物开发方法很难靶向这些融合蛋白。
最新的基于RNA干扰技术的药物模式——小干扰核糖核酸(siRNAs)可以利用序列特异性,靶向融合基因转录出来的mRNA并将其降解。递送是核酸药物成药的关键,利用LNP作为递送载体已经在mRNA疫苗以及siRNA药物递送方面获得了成功。
近日,Hasan Issa 等人在 Leukemia 发表题为 Nanoparticle-mediated targeting of the fusion gene RUNX1/ETO in t(8;21)-positive acute myeloid leukaemia 的文章,首次尝试将siRNA-LNPs系统用于敲低AML细胞中的RUNX1/ETO 融合基因表达,在细胞系和小鼠模型中实现了满意的敲低,并观察到白血病细胞系扩增受限,荷瘤小鼠生存延长。
首先,根据序列特点,作者构建了特异性靶向结合RUNX1/ETO的siRNA,并对siRNA骨架进行化学修饰。细胞系研究结果显示,化学修饰的siRNA在体外显示出增强、持久的敲低活性,并且能抑制AML细胞的生长,论证了化学修饰siRNA分子的成药性。(图1)
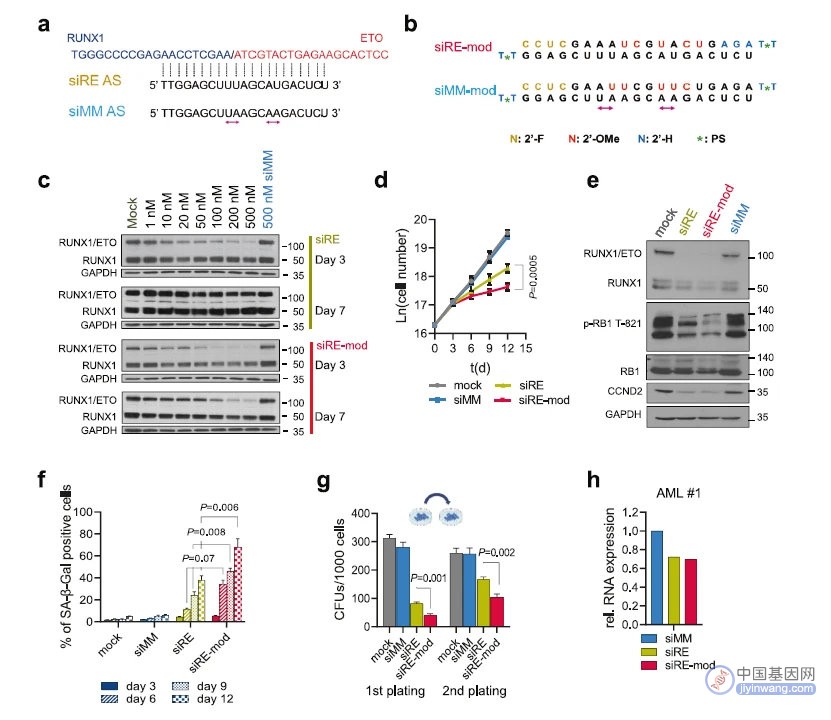
图1 siRNA的序列设计和化学修饰,可以长效敲低目标基因
作者研究了LNP作为药物递送系统的可行性,证明了LNP递送siRNA和电转递送siRNA具有类似的转录组效应和生物学效应。(图2)
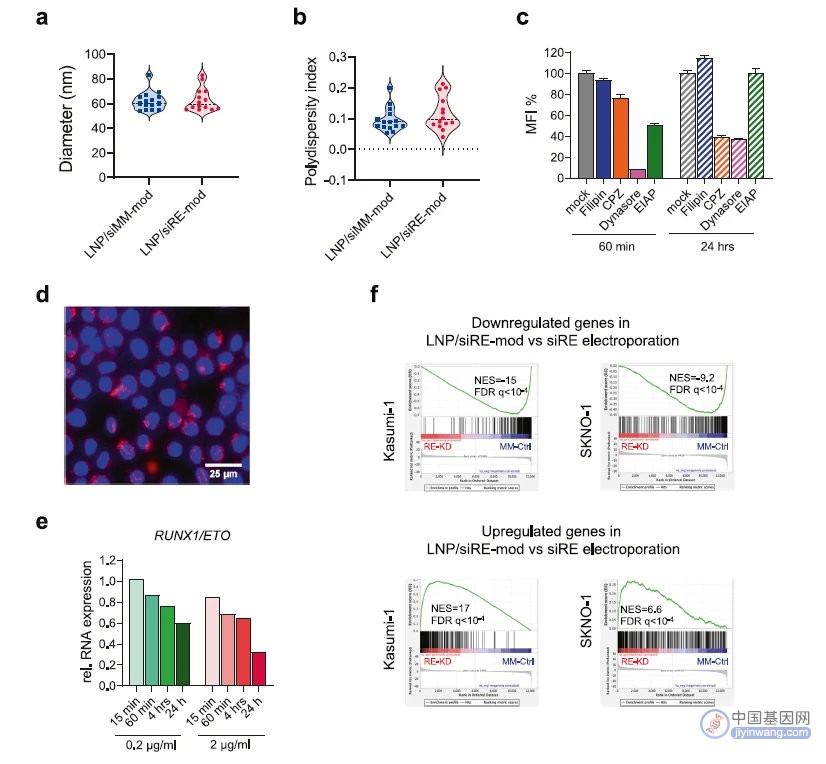
图2 利用LNP递送siRNA实现了RUNX1/ETO的敲低
作者研究了LNP递送的siRNA敲低目标基因表达的效率和动力学。单剂LNP给药后可在Kasumi-1和SKNO-1两个细胞系中降低RUNX1/ETO转录本达70%。在Kasumi-1细胞系中,RUNX1/ETO融合蛋白表达降低的效果持续可长达2周,并影响了细胞的增殖。RUNX1/ETO敲降导致细胞停留在细胞周期的G1相,并诱导细胞衰老。用间充质干细胞培养的患者来源的原代细胞模型可以模拟肿瘤复杂的微环境,在这样的环境中,LNP依然可以实现2倍的对RUNX1/ETO转录本的敲低病,并引起特征性的下游转录组变化。(图3)染色质可及性测序显示,在表观基因组水平上,RUNX1/ETO蛋白结合减少后,转录因子RUNX1蛋白对染色质结合增加。
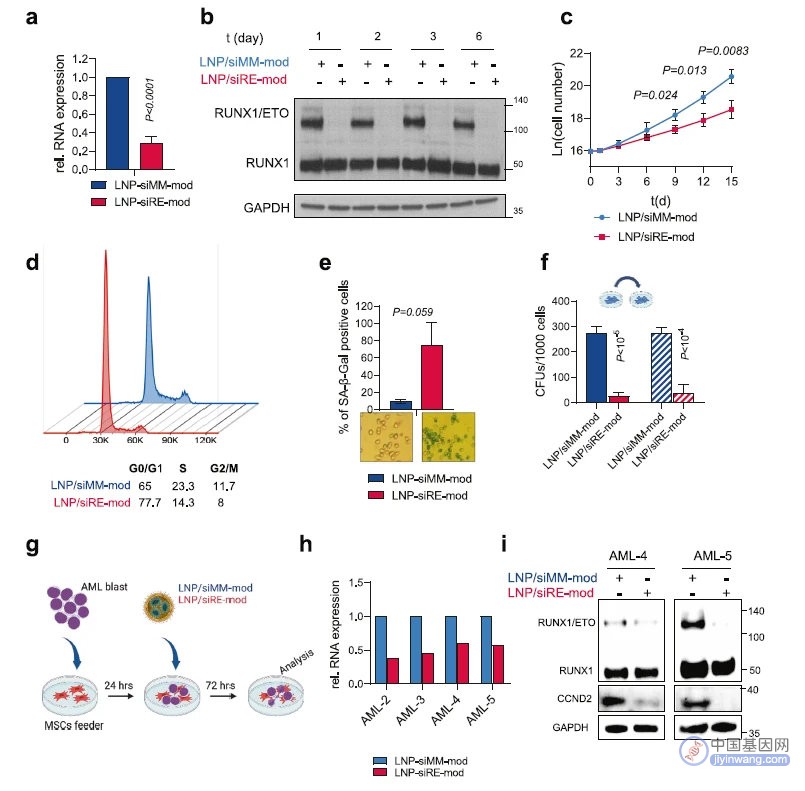
图3 LNP递送的siRNA在细胞系和患者来源的AML细胞中实现对目标基因的持久敲低
在小鼠模型研究中,首先研究LNP颗粒的代谢动力学和生物分布特征。由于肝脏会滞留LNP,所以事先用未标记的LNP将肝脏饱和,然后荧光造影显示LNP分布于肝脏、脾脏、肾脏和心脏,此外还有长骨和大脑。这显示LNP颗粒有广泛的全身分布,使它们有潜能到达白血病病灶部位。荷瘤小鼠的荧光造影显示,LNP颗粒能聚集于白血病病灶部位。(图4)
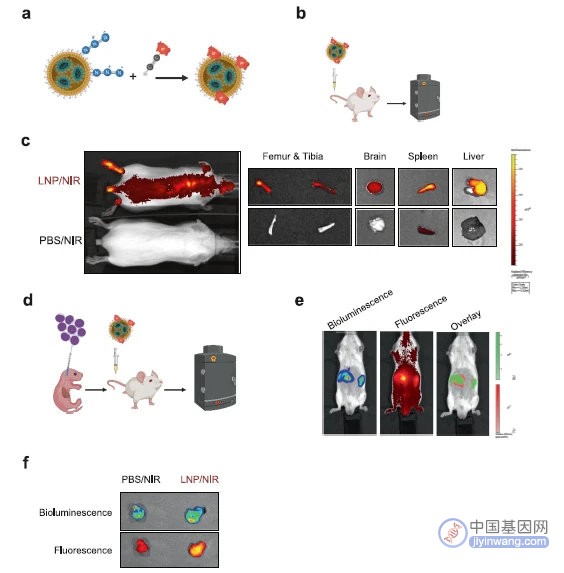
图4 小鼠模型中,LNP递送载体的组织分布特征
其次,作者证明了LNP递送siRNA能敲低小鼠体内肿瘤病灶中的目标基因表达。(图5)
图5 LNP递送siRNA持久敲低小鼠体内肿瘤病灶中的目标基因表达
疗效上,RUNX1/ETO敲低减少了白血病的进展,延长了荷瘤小鼠的生存,并且这种延长小鼠生存的疗效在二次移植的肿瘤中仍然能保持。(图6)
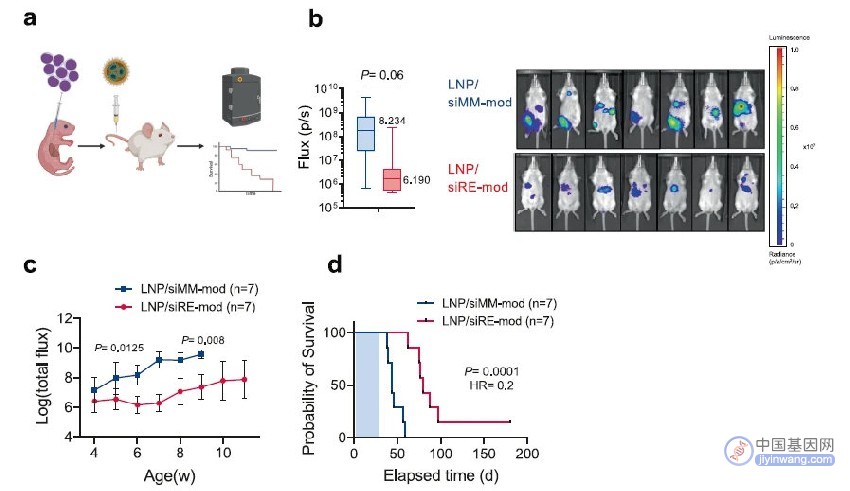
图6 RUNX1/ETO敲低延缓了AML疾病的进程
本研究提示了靶向白血病融合基因作为急性髓性白血病(AML)治疗的潜力,此类疾病,当前的标准治疗方案包括化疗和造血干细胞移植,都属于高强度的治疗。使用RNA干扰技术靶向RUNX1/ETO融合基因,可能是t(8;21)AML患者的有效治疗策略。LNP递送可以成功达到靶病灶,而骨架修饰可以提高siRNA敲低的持久性。这种方法可以干扰体外和体内(即在动物模型中)的白血病细胞生长,表明其作为一种治疗选择的潜力。
原文摘要(Abstract)
A hallmark of acute myeloid leukaemias (AMLs) are chromosomal rearrangements that give rise to novel leukaemia-specific fusion genes. Most of these fusion genes are both initiating and driving events in AML and therefore constitute ideal therapeutic targets but are challenging to target by conventional drug development. siRNAs are frequently used for the specific suppression of fusion gene expression but require special formulations for efficient in vivo delivery. Here we describe the use of siRNA-loaded lipid nanoparticles for the specific therapeutic targeting of the leukaemic fusion gene RUNX1/ETO. Transient knockdown of RUNX1/ETO reduces its binding to its target genes and alters the binding of RUNX1 and its co-factor CBFβ. Transcriptomic changes in vivo were associated with substantially increased median survival of a t(8;21)-AML mouse model. Importantly, transient knockdown in vivo causes long-lasting inhibition of leukaemic proliferation and clonogenicity, induction of myeloid differentiation and a markedly impaired re-engraftment potential in vivo. These data strongly suggest that temporary inhibition of RUNX1/ETO results in long-term restriction of leukaemic self-renewal. Our results provide proof for the feasibility of targeting RUNX1/ETO in a pre-clinical setting and support the further development of siRNA-LNPs for the treatment of fusion gene-driven malignancies.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。