Cell子刊:上科大季泉江团队开发新型微型Cas12n基因编辑系统
CRISPR-Cas基因编辑在基础研究和临床实践上有重大的应用潜力,已经成为了当前生物医药研究中的热点。目前广泛使用的Cas9和Cas12a基因编辑系统存在分子量大、递送困难、编辑位点有限、易于脱靶等缺陷。同时,这些基因编辑系统的底层专利均归属于欧美国家。自然界中存在着种类丰富的CRISPR-Cas系统,但其中被挖掘和表征的系统只是其中的冰山一角。研究和开发具有独特性质的新颖CRISPR-Cas编辑系统,对于推测CRISPR-Cas的演化机制,丰富CRISPR-Cas基因编辑工具库,推动CRISPR-Cas的应用和获得具有自主知识产权的基因编辑系统都具有重要意义。

2023年7月3日,上海科技大学季泉江课题组在 Molecular Cell 期刊发表了题为:Cas12n, early evolutionary intermediate nucleases of type V CRISPR, comprise a distinct family of miniature genome editors 的研究论文。
该研究成功开发了一类能在细菌和人类细胞中进行高效基因组编辑的新型微型CRISPR-Cas12n系统。

CRISPR-Cas12n是一类V-U4型CRISPR-Cas系统,与V型CRISPR系统的祖先——转座相关核酸酶TnpB具有最近的亲缘关系,可能是TnpB演化为其它V型Cas核酸酶的最早进化中间体。目前尚没有对该类CRISPR-Cas系统的性质和功能的研究报道。
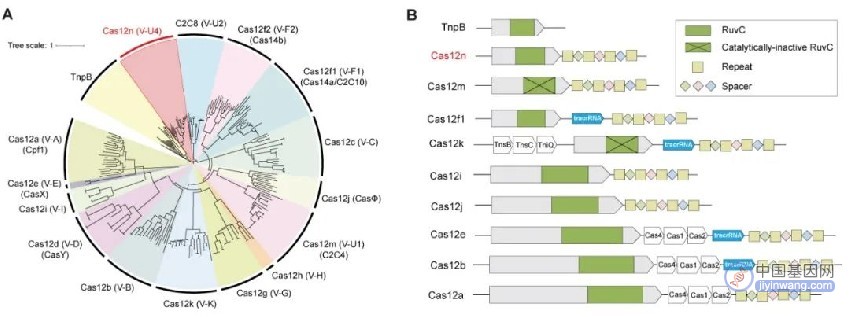
图1. Cas12n系统的进化分析
研究人员对CRISPR-Cas12n进行了系统表征并发现CRISPR-Cas12n是一类微型基因编辑系统(仅含400-700个氨基酸),识别罕见的AAN PAM序列, tracrRNA位于Cas12n mRNA内部,对被靶DNA序列产生两次切割,效应复合体中Cas12n核酸酶可能为单体分子。这些特征均与TnpB较为相似,这进一步证明了Cas12n与TnpB两者之间的亲缘性。与同为V型CRISPR系统的Cas12a和Cas12f相比,Cas12n系统在PAM识别序列、tracrRNA所在位置以及效应复合物结构特征方面均存在显著差异。
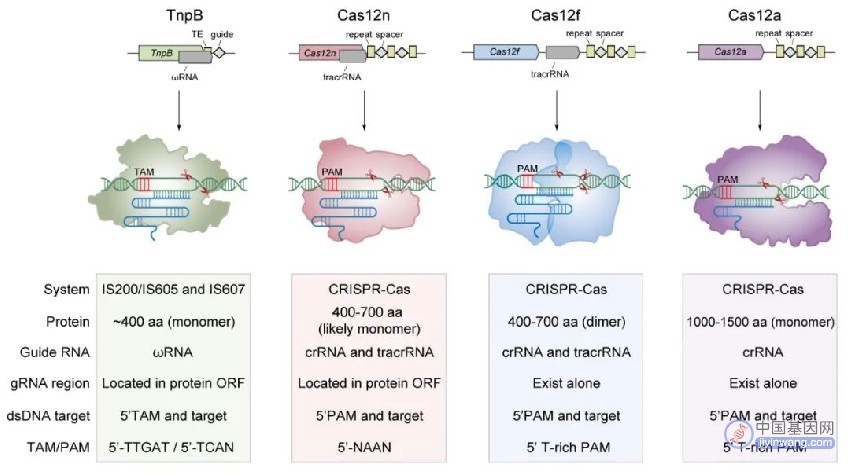
图2. Cas12n与TnpB、Cas12f以及Cas12a的生化特征比较
在筛选了多种不同来源的CRISPR-Cas12n系统后,研究人员发现其中一种来源于海洋放线菌Actinomadura craniellae的Cas12n核酸酶(AcCas12n)具有较高的基因编辑活性。研究人员对AcCas12n系统进行了相关表征,发现AcCas12n能够高效地切割DNA双链,产生黏性末端,并进一步确定了切口特征。此外,研究人员系统性地探索了AcCas12n对反应温度、盐离子浓度、二价金属离子种类以及靶向序列长度的选择性,获得了最适宜的反应条件。该系统能够在活细胞中进行高效基因组编辑,在细菌中的编辑效率接近100%,而在人体细胞中的编辑效率,最高接近80%。
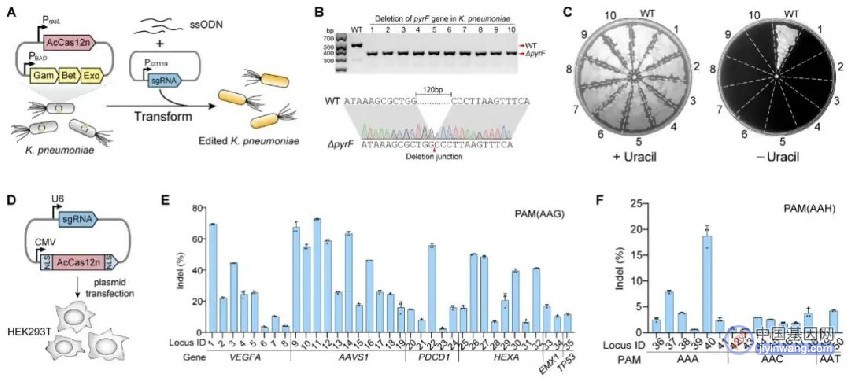
图3. AcCas12n系统在细菌和人体细胞中的基因编辑
研究人员还对AcCas12n系统进行了进一步优化,通过对引导RNA (sgRNA) 的优化改造,得到了优化版本Cas12Pro,进一步提升了该系统的编辑效率。此外,研究人员对Cas12Pro进行了全面的表征,包括在人体细胞中多个不同位点的编辑效率检测、使用腺相关病毒(AAV)载体在人体细胞中进行基因编辑、使用Guid-seq检测细胞全基因组水平的脱靶效应等。同时研究人员将Cas12Pro系统与目前最常用的Cas9和Cas12a系统进行比较。实验结果发现,Cas12Pro系统在大多数位点的编辑效率接近Cas9和Cas12a系统,表明该系统在基因编辑领域具有重要的应用潜力。
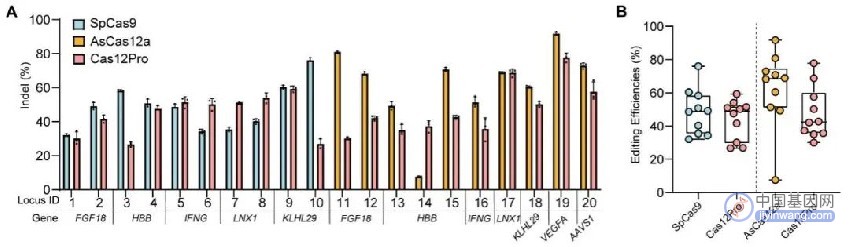
图4. Cas12Pro系统与Cas9以及Cas12a系统的基因编辑效率比较
CRISPR-Cas12n家族核酸酶是我国自主研发的新颖微型基因组编辑系统,拥有该家族系统的自主知识产权及底层专利。上海科技大学季泉江课题组前副研究员陈未中和博士研究生马佳诚为该论文的共同第一作者。上海科技大学季泉江教授为通讯作者。上海科技大学为第一完成单位。
论文链接:https://doi.org/10.1016/j.molcel.2023.06.014
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。