基因科普:基因编辑技术发展的“前世今生”【全文】
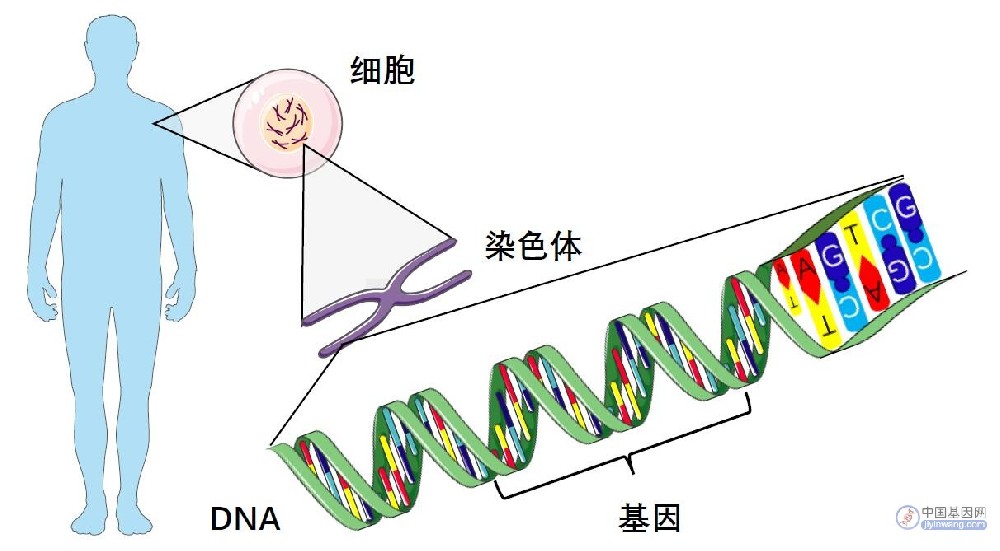
基因编辑(gene editing),又称基因组编辑(genome edting)或基因组工程(genome engineering),是一种新兴的、比较精确的能对生物体基因组特定目标基因进行修饰的一种基因工程技术。简单来说,就是利用一个经过改造的蛋白作为工具,对指定的基因进行定向改造。而这个工具则是一个由序列特异性的DNA结合结构域和非特异性的DNA修饰结构域组合而成的序列特异性核酸内切酶。
一般来说,基因编辑的过程可概括为三个步骤:定位、切除、修补。
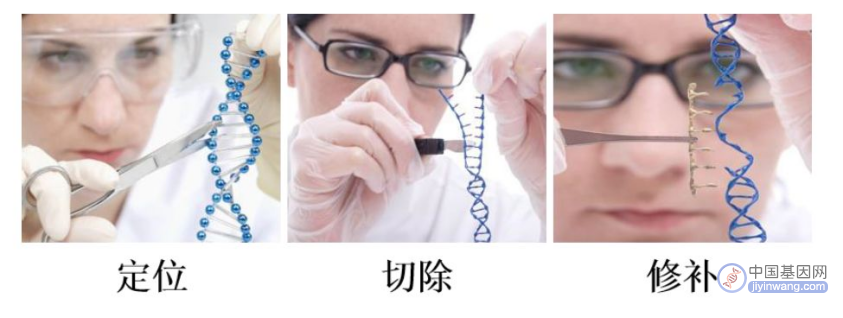
定位异常基因:在DNA上找到需要进行编辑的位置,即识别染色体上的DNA靶位点;
切除异常基因片段:定位到目标位置以后,通过内切酶将错误的基因片段切除;
修补恢复成正常基因:内切酶把错误的基因片段切除后,会在DNA上形成一段缺口,这时只需要把对应的正确基因片段插入到这个缺口中并与原DNA进行连接即可完成DNA的修复。
通常,修复缺口的机制包括:
①内源性的非同源末端连接(Non-homologous end-joining,NHEJ),这是细胞自身的随机修复机制,且不需要同源模板,可直接将DNA末端连接在一起,但NHEJ途径错配率较高,易造成DNA损伤位点碱基序列的改变(错配和丢失),从而导致遗传信息的丢失;
②同源重组修复(Homology-directed repair,HDR),即在有同源序列作为修复模板的条件下,外源的目的基因能通过同源重组整合入靶基因,降低了错误率;
③选择性末端修复(alternative end-joining,a-EJ)和单链退火修复(single strand annealing,SSA),作为辅助性的修复机制,a-EJ和SSA均需要更大幅度的末端单链切除,这也会导致遗传信息的丢失。
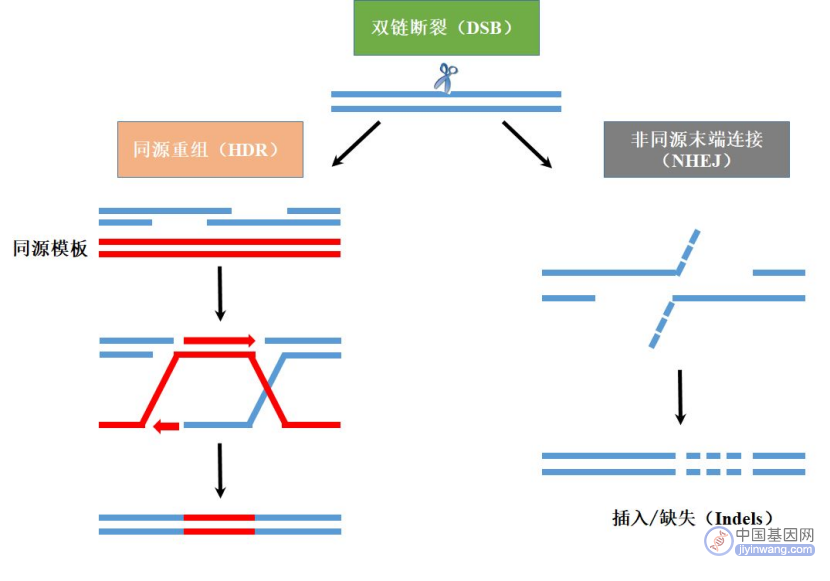
来源:参考资料3
作为生命科学发展迅速的重要研究领域,基因编辑技术的开发及应用使得生物体的遗传改造进入了前所未有的深度与广度。同时,该技术在基因功能研究、药物开发、疾病治疗等方面的广阔应用前景也使其成为了世界范围内竞争最为激烈的下一代核心生物技术之一。
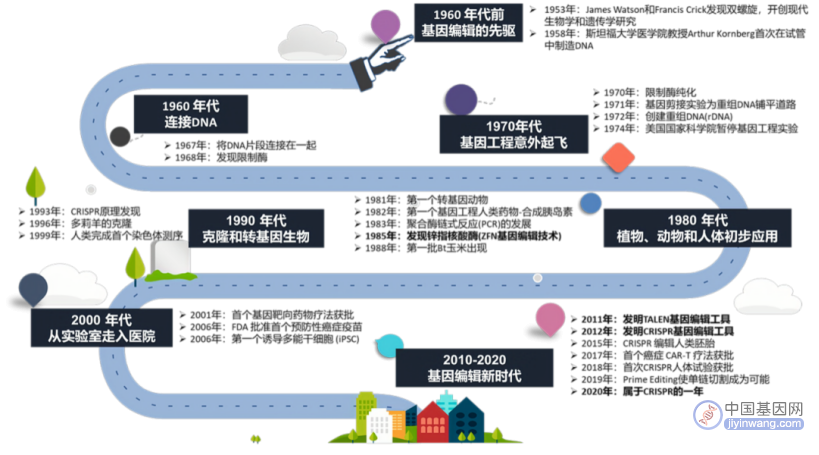
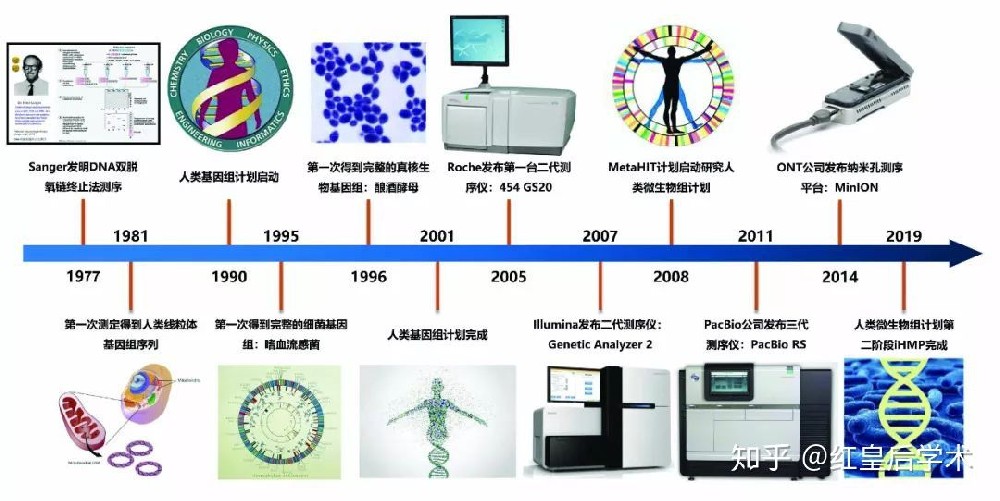
基因编辑技术的发展历程(来源:参考资料2)
一、
基因编辑技术的更迭
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
1、同源重组(homologous recombination,HR)
20世纪70年代,科学家在研究细菌如何防御噬菌体过程中发现限制性内切酶可以保护细菌免受噬菌体的侵害,这个发现具有里程碑式的意义,科学家发现可以对基因组进行编辑。20世纪80年代,Smithies等和Capecchi发现,可以通过同源重组将外源DNA整合到哺乳动物的基因组中,但这种方法有很大的局限性,不仅整合效率极低(整合效率取决于细胞的状态和类型),而且容易脱靶。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
2、归巢内切酶(Homing Endonuclease,HEs)
20世纪80年代末期,Rudin等和Rouet等发现,在靶标位置引入双链断裂的DNA(double-strand break,DSB)会显著提高目的基因的整合效率。研究人员最早通过归巢核酸内切酶(也称大范围核酸内切酶)在基因组中引入特定的双链断裂DNA。归巢核酸内切酶能够识别14~40bp的DNA片段,识别之后绝大部分通过NHEJ途径修复。人们在自然界中已经找到数百种归巢核酸内切酶,使用最广泛的主要有3种:Ⅰ-SceⅠ、Ⅰ-CreⅠ和Ⅰ-DmoⅠ。
然而,通过归巢核酸内切酶进行基因编辑存在很大的制约性:
尽管有数百种的归巢核酸内切酶,每个都有自己独特的识别序列,但要找到适合靶向特定基因序列的归巢核酸内切酶的概率极低;
由于DNA双链断裂主要通过NHEJ途径修复,该修复机制不能引入外源的DNA模板,并且会在断裂位点随机删除或者插入DNA片段。
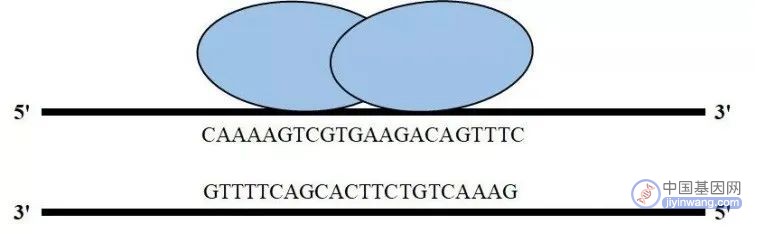
归巢核酸内切酶技术简图(来源:参考资料3)
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
3、第一代基因编辑技术—ZFNs技术
人工核酸酶技术的发展使人为定点诱导DSBs成为现实,其中锌指核酸酶技术(zinc finger nucleases,ZFNs)就是一个里程碑式的突破,也称为第一代基因编辑技术。
锌指蛋白(Zinc finger protein,ZFP)是一类通过Cys2-His2锌指结构域结合DNA的转录因子,由一个α螺旋和两个反向的β平行形成紧密的ββα结构,能特异性识别3个连续的碱基对。ZFNs是通过设计锌指结构域以及多个锌指蛋白的不同连接顺序实现特异性结合靶标基因和限制性核酸内切酶FokⅠ进行定点切割的技术。值得注意的是,FokⅠ核酸酶需要形成二聚体才可切割DNA产生DSB,为避免FokⅠ自身二聚化,将FokⅠ设计为异源二聚体,这样的设计也增强了ZFNs的结合特异性。
目前ZFNs可以通过HDR或NHEJ来修饰体细胞和多功能干细胞的基因组。该技术靶向结合效率高,但是蛋白设计复杂,费时费力,并且无法实现对任意靶基因的结合,也无法实现高通量的基因编辑。作为新型基因编辑工具,ZFNs从1996年问世,在2001年开始被陆续用于不同物种的基因编辑。
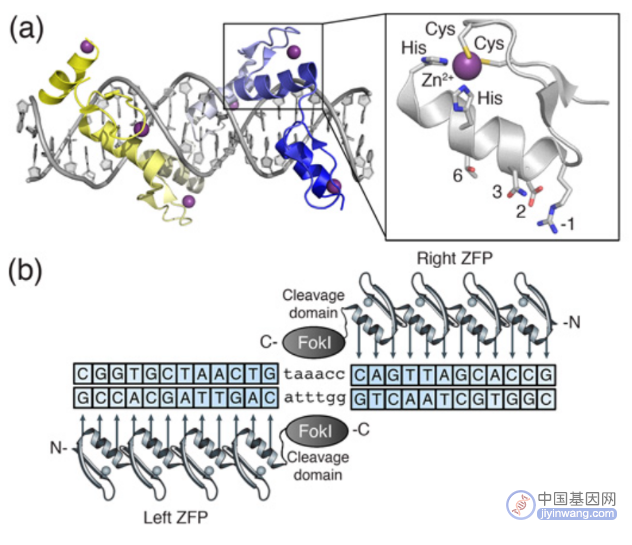
ZFNs结构图(来源:参考资料5)
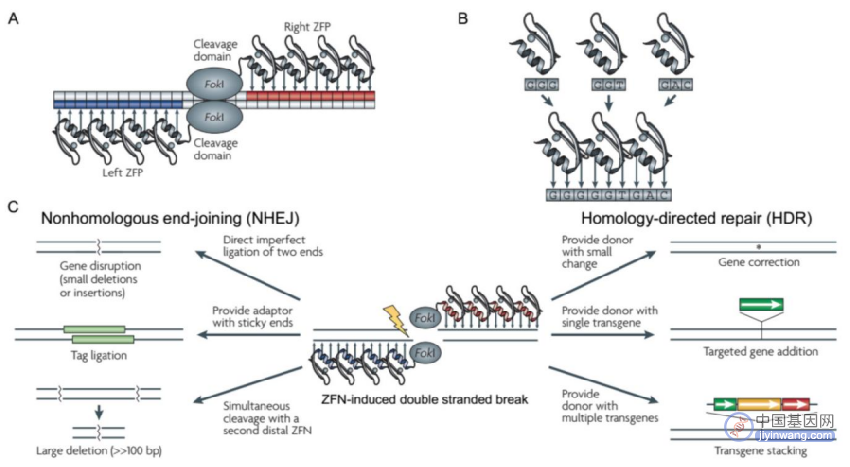
锌指蛋白基因编辑原理(来源:Nature Reviews Genetics)
然而该技术也有局限性:
可编辑的靶基因位点有限,有限的锌指蛋白类别只可识别有限的DNA序列;
ZFNs基因编辑的效率低,只有30%左右;
操作复杂,成本高,容易脱靶。
一直以来,科研人员都在不断改进ZFNs技术,2014年,Tebas等通过ZFNs编辑艾滋病毒(HIV)感染者自体CD4 T细胞中的艾滋病毒入侵辅助受体CCR5来治疗艾滋病。但是,目前ZFNs技术存在专利封锁。ZFNs核心技术专利掌握在数位科学家手中,这些科学家陆续加入或专利授权给美国Sangamo,其获得了ZFNs设计、筛选、优化、实验室和临床应用相关的数个关键专利,将其垄断。目前,ZFNs技术自问世以来无大规模应用,且无突破性进展。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
4、第二代基因编辑技术—TALENs技术
类转录激活因子(transcription activator-like effector,TALE)是植物病原菌黄单孢菌中的一种效应因子。2009年,Boch等和Moscou等发现,类转录激活因子蛋白可以识别DNA序列。2011年,第二代基因编辑技术——类转录激活因子效应物核酸酶TALENs诞生。
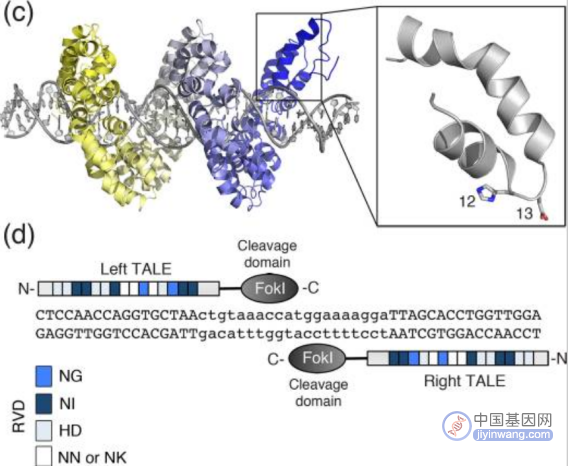
TALENs结构图(来源:参考资料5)
与ZFNs一样,TALENs在形式和功能上也是模块化的,由FokⅠ切割结构域和TALE蛋白DNA结合结构域融合组成,同样利用限制性核酸内切酶FokⅠ进行基因编辑。
TALE蛋白由33–35个氨基酸的重复单元组成,通过位于12位和13位的两个可变氨基酸残基识别并结合DNA序列,这两个位点的氨基酸残基称为重复可变的双氨基酸残基(repeat variable diresidue,RVD),每个重复单元能特异性识别一个碱基对。
TALENs的唯一靶向限制是对N端结构有5'T的要求,因此,通过构建不同的RVD和改变TALE的连接顺序,理论上可以使TALENs被用于几乎任何的序列。2011年TALENs技术开始用于人类细胞的基因编辑,如靶基因的敲除等。
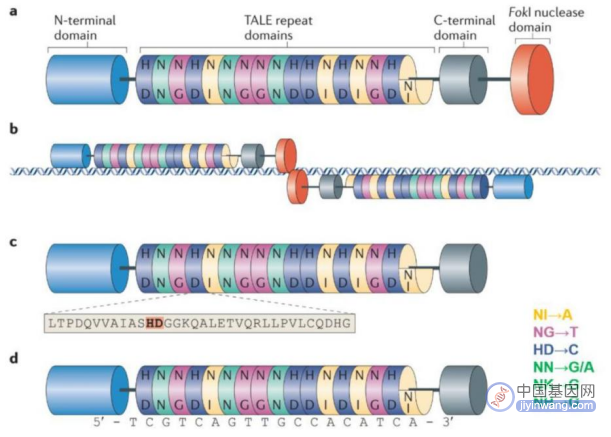
TALENs基因编辑原理(来源:Nature Reviews Molecular CellBiology)
与ZFNs相比,TALENs的毒性低,蛋白设计相对简单,是首个真正意义上的基因可编辑工具。但是TALENs重复序列更多,工作量巨大,此外,TALENs的体积比ZFNs大,这使得某些病毒传递系统的包装较困难,也无法用于高通量的编辑。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
5、第三代基因编辑技术—CRISPR/Cas技术
5.1 CRISPR/Cas的发现
CRISPR/Cas(clustered regularly interspaced short palindromic repeats / CRISPR-associated proteins)技术又被称为第三代基因编辑技术,是基于原核生物(细菌和古生菌)一种免疫系统而开发的,是目前应用最为广泛的基因编辑工具。
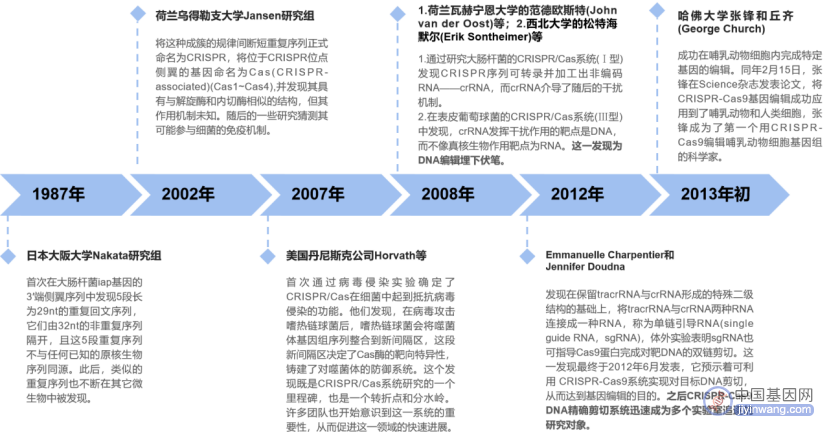
CRISPR/Cas发展史大事记(来源:公开资料,小编自制图)
在CRISPR/Cas的发展史中,值得注意的是,其实2010年,科学家们就已经对CRISPR/Cas系统的基本生物学作用和分子机制有了较为清晰的理解,并将其应用于减少细菌噬菌体感染和细菌进化分析等,但当时CRISPR/Cas系统的应用范围极为有限。主要原因在于当时已研究的两种类型(Ⅰ型和Ⅲ型)都过于复杂,因此,寻找更为简单的体系成为了一个重要方向。
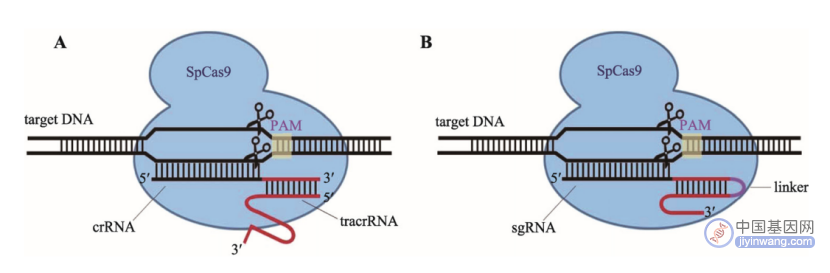
crRNA-tracrRNA改造为sgRNA示意图(A:天然化脓性链球菌内的“靶向DNA-crRNA-tracrRNA-SpCas9”复合体;B:将crRNA和tracrRNA改造为sgRNA后的模式图。来源:参考资料6)
5.2 CRISPR/Cas的作用机制
经过多年的研究,人们对CRISPR/Cas系统的作用机制有了相对清晰的了解。以CRISPR-Cas9为例,细菌对外来病毒的入侵分为3步:
(1)病毒入侵时,CRISPR/Cas系统将病毒的DNA切成短片段,并插入重复序列之间,作为“记忆”储存;
(2)同种病毒再次入侵时,CRISPR阵列及Cas9基因转录,Cas9翻译为蛋白,转录出的tracrRNA与pre-crRNA互补配对,经过内源核糖核酸酶(RNase)加工成熟,最后形成Cas9-crRNA-tracrRNA的三聚体;
(3)在crRNA与病毒DNA互补配对之前,Cas9需要与特定的PAM序列结合以区别病毒和自身基因组,Cas识别并结合PAM后将DNA双链解旋,crRNA在PAM上游与目标序列互补配对。在PAM和靶点序列均匹配时,Cas9构象发生改变,其双链内切酶的活性被激活,在PAM上游的特定位置将病毒的双链DNA切断。
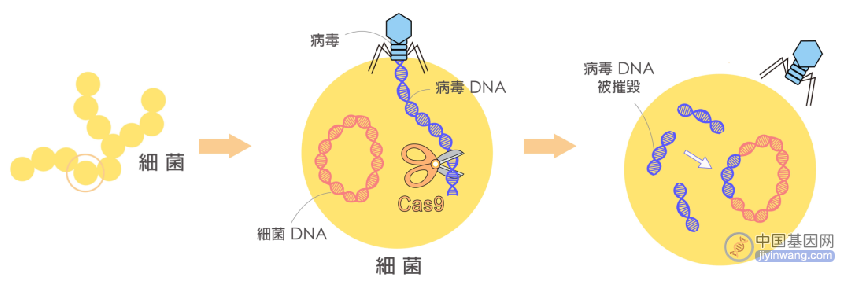
CRISPR的来历(来源 :https://research.sinica.edu.tw/gene-editing-crispr-lin-chia-hung/)
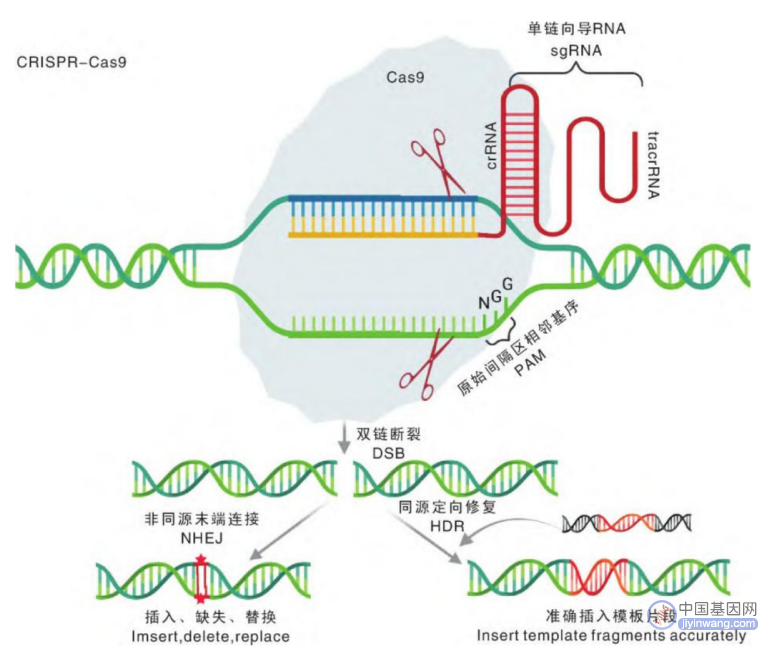
CRISPR-Cas9基因编辑原理(来源:参考资料8)
模拟上述防御机制就是进行基因编辑的基础。首先,利用基因编辑位点处DNA的碱基互补配对原则来设计一个guide RNA,guide RNA与Cas蛋白结合之后,就会找到需要基因编辑的相应DNA片段位点,并且剪断该位点的DNA。与此同时,递送一个正确的基因作为模版,那么,细胞就有机会把正确的模版拿来修补DNA的缺口,完成基因编辑。
目前,科学家们已经发现了多种CRISPR/Cas系统,根据Cas蛋白的数量可以分为两类(ClassⅠ和ClassⅡ),跟据Cas的结构和功能可分为6种(TypeⅠ~VⅠ),并可进一步分为多个亚型。相比ClassⅠ,ClassⅡ仅需一个Cas蛋白,因此目前基因编辑中常用的系统均为ClassⅡ,比如Cas9,以及不需要tracrRNA的Cpf1(Cas12a)和具有RNA切割活性的Cas13。

来源:参考资料4
与ZFNs和TALENs相比,CRISPR/Cas系统的优势主要体现在系统设计简便、可实现多基因编辑等。以CRISPR-Cas9为例,发挥DNA剪切功能的Cas9元件是通用的,因此只需要根据靶基因的不同设计相应的gRNA即可,其设计难度和复杂度远低于ZFNs和TALENs,大大拓展了CRISPR/Cas系统的应用前景。
此外,CRISPR/Cas系统还具有基因编辑效率更高、操作成本低等多方面的优势。然而,CRISPR技术出现时间还太短,科学家还无法充分预估其潜在风险。相比CRISPR技术,TALENs的脱靶效应更低,更加稳定。
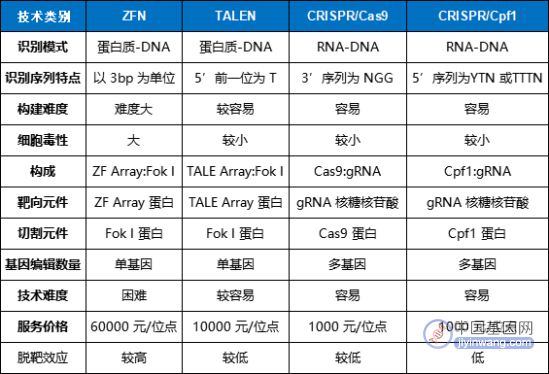
基因编辑技术参数对比(来源:参考资料2)
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
6、CRISPR/Cas衍生的新一代靶向基因编辑
6.1 碱基编辑技术(BE)
2016年和2017年,刘如谦实验室分别将胞嘧啶脱氨酶或腺苷脱氨酶与Cas9结合,从而开创性地建立了新一代基因编辑系统——碱基编辑器(Base Editor,BE)。BE是在CRISPR-Cas9技术的基础上设计的,由sgRNA和融合蛋白组成。其中,融合蛋白为经过改造的Cas9、胞嘧啶脱氨酶和尿嘧啶糖基化酶抑制子的复合体。
BE系统包含了胞嘧啶碱基编辑器(Cytidine Base Editors,CBE)和腺嘌呤碱基编辑器(Adenine Base Editor,ABE),可以在不需要模板DNA和双链DNA断裂的情况下分别实现胞嘧啶(C)与胸腺嘧啶(T)、腺嘌呤(A)与鸟嘌呤(G)核苷酸之间的转化。其中,ABE可实现A到G(或T到C)的转换,理论上可解决47%的基因致病突变导致的人类疾病。
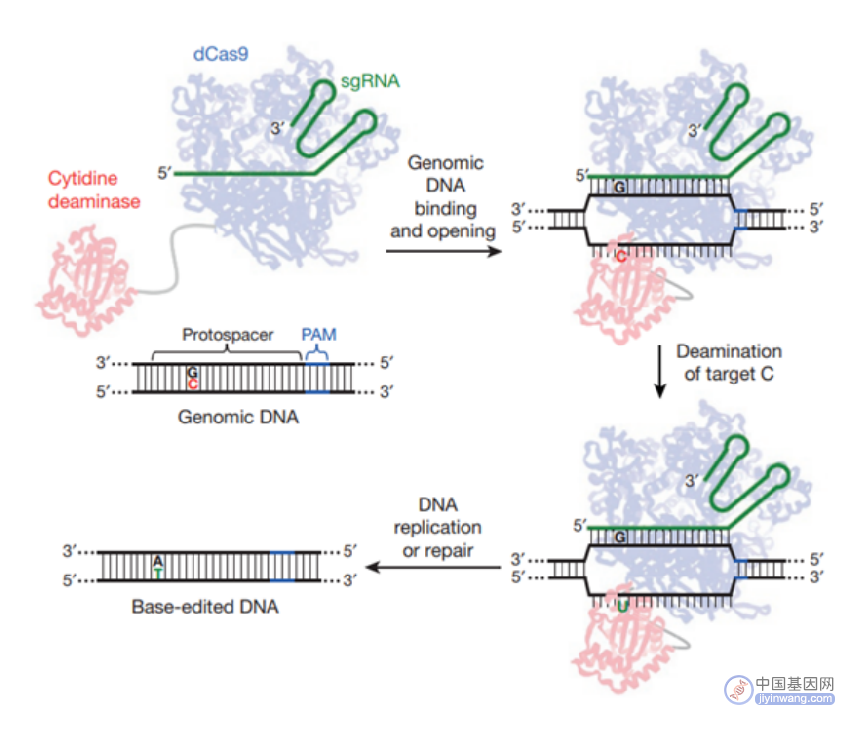
CBE技术原理(来源:参考资料10)
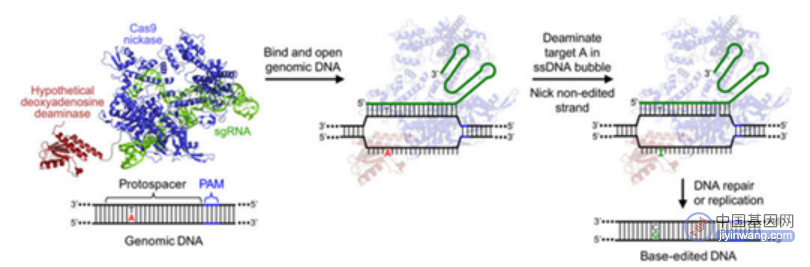
ABE技术原理(来源:参考资料10)
另外,研究人员还在CBE的基础上进一步开发了鸟嘌呤编辑器(Guanine Base Editor,GBE),可实现现胞嘧啶(C)与鸟嘌呤(G)的特异性转换。
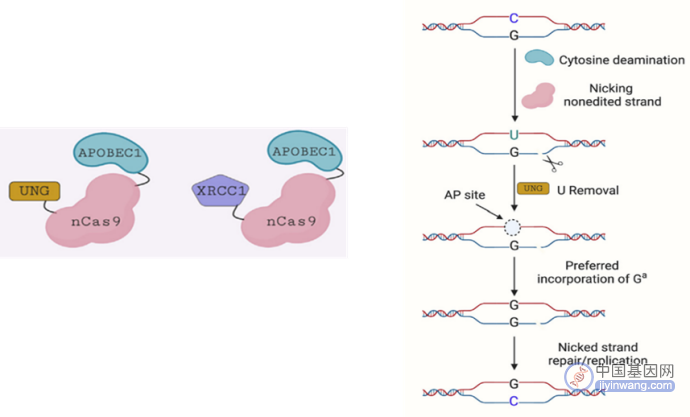
GBE技术原理(来源:参考资料8)
除上述以外,近些年来,研究人员通过将胞嘧啶脱氨酶、腺嘌呤脱氨酶和Cas9切口酶相融合,开发出了腺嘌呤和胞嘧啶双碱基编辑器(ACBE),这一双碱基编辑器可以在同一靶标位点实现C-T和A-G转化,研究表明ACBE的C-T编辑效率与CBE相当,对A-G编辑效率则略有降低;但总体来说该双碱基编辑器效率高于CBE+ABE。
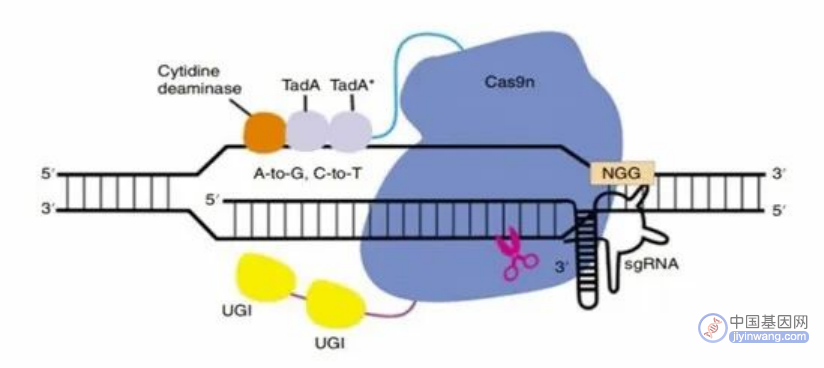
ACBE技术原理(来源:参考资料8)
另外,就在去年,赖良学课题组通过将GBE和ABE融合构建出了AGBE编辑器,由于GBE除可实现C-to-G转换外,还存在C-to-T和C-to-A两种副产物。因此利用AGBE对C-to-G、C-to-T、C-to-A和A-to-G的编辑特性,可用其建立饱和突变群体,以通过高通量筛选验证多种基因突变模式如单核苷酸变异(SNV)的功能及相关表型。
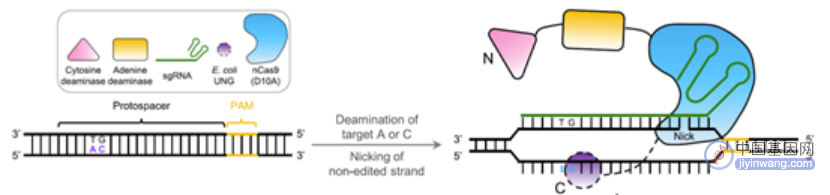
AGBE技术原理(来源:参考资料8)
BE的发现,在实现精确和高效的基因组编辑的同时将最大限度地减少不需要的副产物和与双链DNA断裂相关的细胞毒性。
但是,BE也存在着一定问题和局限性。一方面,现有的BE仅能完成特定的4种形式的碱基转换,缺乏完成精确可控的碱基颠换或者片段插入缺失等其他基因组编辑的能力;另一方面,BE往往仅能在向导RNA(guide RNA)识别区域中有限编辑窗口内发挥高效作用,编辑区域受到编辑器Cas蛋白PAM识别能力和编辑器窗口范围的双重限制,因此无法编辑基因组中一些重要位点。
此外,BE自身编辑的精确性还有待进一步优化。例如,编辑器脱氨酶,特别是CBE的胞嘧啶脱氨酶,存在序列非特异活性,可能在全基因组范围出现脱靶;同时当编辑窗口内存在多个可编辑碱基时,编辑器在编辑目标碱基时也会造成其他非靶向的碱基突变。
6.2 先导编辑(PE)
介于BE系统的脱靶现象,2019年,刘如谦团队报道了所开发的全新基因编辑技术——先导编辑(Prime Editor,PE,也称为引导编辑),不仅较好解决了脱靶的问题,而且可以实现全部12种可能的碱基转化。
PE系统以CRISPR-Cas9为基础,在sgRNA3’末端增加一段RNA序列,新获得的RNA被称作pegRNA,它不但能够结合想要进行编辑的特定DNA区域,还自带“修改模板”。除了可对单个碱基进行修改之外,这一系统还能够插入或删除特定的DNA序列。
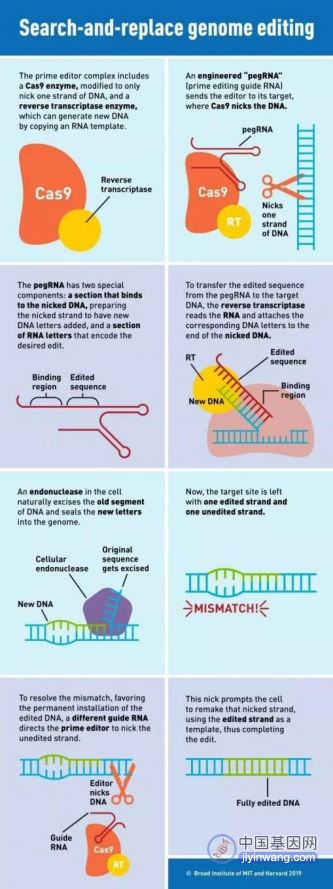
PE技术原理示意图(图片来源:Susanna Hamilton,Broad Institute)
目前,PE技术还不成熟,其可靠性有待进一步研究,而且与碱基编辑技术相似,使用逆转录酶和脱氨酶仍然存在安全隐患。
6.3 PASTE
不依赖DNA修复可编程多重整合大片段仍是现阶段基因组编辑的一个难题。目前的基因整合方法产生双链断裂,从而引发DNA损伤,并依赖于终末分化细胞中不活跃的DNA修复途径。PE尽管绕过了双链断裂,但仅限于修改或插入短序列。而新开发的PASTE系统正好解决了这一难题。
PASTE将丝氨酸整合酶与引导编辑结合,可在细胞中可编程高效多重整合大片段。丝氨酸整合酶包含AttP附着位点和靶向的AttB附着位点,通过将46bp的AttB附着位点设计在引导编辑的pegRNA中,将其插入到基因组中作为整合酶的靶点。这些蛋白可以以反式提供,也可以直接融合到Cas9蛋白中表达。同时递送含有AttP附着位点的环状双链DNA模板,目的基因可以在单次递送反应中直接整合到目标位点。
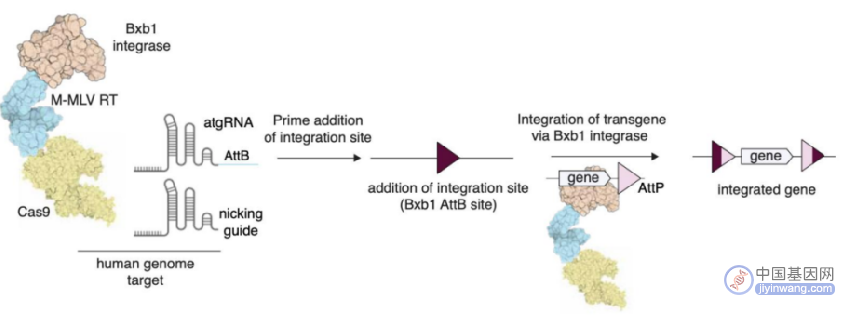
PASTE技术原理(来源:参考资料8)
目前,PASTE可在三种人类细胞系、原代T细胞和静止不分裂的原代人肝细胞的多个基因组位点上整合高达36kb的序列,效率在10-50%之间。PASTE的编辑效率与依赖于同源修复或非同源末端连接的整合相当或更好,在非分裂细胞中具有活性,且更少可检测到的脱靶事件。若应用于疾病治疗,PASTE可以用mRNA递送,可编程地直接插入腺相关病毒或腺病毒载体携带的DNA模板。
PASTE通过拖放式整合目的基因,扩展了基因组编辑能力,为研究、细胞工程和基因治疗提供了一个广泛适用的平台。
二、
基因编辑技术的应用领域
目前,基因编辑技术的开发及应用范围非常之广,其在基因功能研究、药物开发、疾病治疗以及作物育种等方面都有着重要意义和广阔的应用前景。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
1、疾病模型
很多疾病的致病机制十分复杂,比如癌症,通常涉及多种抑癌基因或致癌基因的遗传改变。因此构建适合的疾病模型对探索疾病的发生和进展以及抗癌药物的筛选有着重要的意义。
对于已知致病基因的疾病,研究人员可以运用CRISPR-Cas9等基因编辑技术,构建对应的基因突变动物或细胞模型,从而进一步进行药物或其他治疗方式的研究;对于功能未知或者部分未知的基因,研究人员可以通过构建疾病模型从而进一步明确疾病与基因之间的关系。
目前,研究人员应用基因编辑技术,已经实现了多种疾病的体内和体外疾病模型的构建。其中在鼠科动物上,研究人员实现了多种疾病模型的构建,如利用CRISPR技术靶向Pten和p53(两种抑癌基因)构造的肝癌模型,以及诱导CD74-ROS1、EML4-ALK和KIF5B-RET融合导致的肺癌模型等。
另外,对于一些由多基因突变导致的人类复杂疾病,CRISPR-Cas9技术可以同时进行多基因编辑,如Zuckermann等通过在小鼠大脑中单基因敲除(Ptch1)和多基因敲除(Trp53,Pten,Nf1),成功构建了成神经管细胞瘤和成胶质细胞瘤疾病模型。
此外,研究人员还用CRISPR-Cas9技术在小鼠中构建了心肌病和心力衰竭模型。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
2、靶向基因治疗
广义上的基因治疗是指在DNA水平上,通过特定的技术手段用正常的基因来替换或者补偿致病基因突变,从而达到治疗目的。常用的基因治疗方法包括用非病毒载体方法、慢病毒载体或腺病毒载体向体内注射正常基因,或者利用近几年崛起的基因编辑技术纠正致病突变等。
传统的基因治疗手段可将正常基因导入细胞,但致病突变依然存在,不能从根本上治愈疾病。而基因编辑技术可以对基因进行精准编辑,从而修复或修饰内源致病突变。因此,以CRISPR-Cas9系统为代表的基因编辑技术在临床治疗上具有广阔的应用前景。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
3、动植物育种
应用CRISPR-Cas9等技术在农作物或动物基因中进行基因编辑,与传统杂交等育种方法相比,可以精确、快速培育出新品种。
在植物育种方面,研究者利用基因编辑技术可以加速作物培育过程或获得利于其生长的抗性。如在水稻中对OsEPSPS基因(编码与草甘膦具亲和能力的5-烯醇式丙酮酰莽草酸-3-磷酸合成酶)进行定点替换,可获得抗草甘膦除草剂的表型,以及通过基因敲除、改造启动子等方法加速水稻培育过程、获得抗旱和抗其他类型除草剂的农作物品种等。
在动物品系培养方面,研究者同样可以通过基因编辑技术得到具有优良性状的猪、牛、羊等家畜。如研究者利用ZFNs和CRISPR-Cas9技术通过MSTN基因敲除获得了高瘦肉率转基因猪。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
4、微生物设计
基因编辑技术为工业微生物的改造与模式微生物设计提供了高效的工具,为生物燃料、化学品、新材料、医药产品、环境修复微生物等研发提供了新的选择。例如,中科院微生物研究所温廷益团队在2018年发展了一种CRISPR-Cas9辅助多重基因组编辑方法,包括多重基因敲除、多位点和多拷贝整合方法,为酵母的基因工程和合成生物学研究提供了一个有效的工具。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
5、基因诊断与核酸检测
CRISPR系统具有用一条sgRNA靶向DNA或者RNA的特性,利用该特点研究者开发了一系列的工具用于检测样品中是否存在某种特定的核酸,从而实现即时检测病原体、基因分型和疾病监测等功能。
2018年,科学家首次证明了基于CRISPR的基因编辑技术在病毒核酸检测方面的重大应用潜力,两项代表性工作都来自麻省理工学院张锋团队,一项是利用CRISPR-Cas12a系统可以准确地识别人源样本中不同类型的HPV病毒;一项是利用基于CRISPR-Casl3a的SHERLOCK系统检测人源样本中的寨卡病毒,登革热病毒以及其他有害细菌。
2020年,张锋团队又开发出了利用基于CRISPR-Cas13的SHERLOCK系统快速检测新型冠状病毒。而国内首次批准利用CRISPR技术的新冠病毒检测试剂盒则是2020年12月,由杭州众测生物研发的新型冠状病毒2019-nCov核酸检测试剂盒(CRISPR免疫层析法)。
由于在IVD领域,相较于传统PCR技术而言,CRISPR技术具有诸多优势,如诊断特异性极好、技术操作简单、对仪器设备依赖性低、价格低廉以及结果可视化等,因此,家庭用CRISPR诊断试剂盒也是目前许多公司发展的方向。

CRISPR技术与传统PCR技术比较(来源:公开资料)
三、
基因编辑技术的关键问题
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
1、脱靶效应
脱靶效应就是识别到非靶标基因也会进行基因编辑,虽然已经有基于CRISPR-Cas9技术的多种衍生改良技术的出现,例如为降低脱靶效率设计的CRISPR-Cas9-nickase基因编辑技术、CRISPR-Cas9-FokⅠ基因编辑系统和能与Cas9系统实现功能互补的CRISPR-Cas12a基因编辑技术,还有能实现对RNA进行基因编辑的Cas13a、Cas13b、Cas13d系统,这些技术降低了脱靶率并且提高了精准度,但是依旧无法完全解决这个问题。脱靶效应是目前制约基因编辑技术发展的一个重要因素,也是亟待解决的核心问题。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
2、效率问题
研究表明CRISPR-Cas9技术进行HDR相比NHEJ的效率低,仅为3.5%到15.6%。有研究显示HDR依赖于sgRNA和Cas9的浓度,但是提高sgRNA和Cas9的浓度会增加脱靶效应。因此,平衡sgRNA和Cas9的浓度,提高HDR的效率也是需要解决的问题之一。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
3、运输问题
目前病毒载体广泛应用于CRISPR-Cas9技术,包括腺病毒载体(AdVs)、整合酶缺陷型慢病毒载体(IDLVs)和重组腺相关病毒载体(rAAVs),这些病毒载体都不会整合入宿主DNA中。IDLVs载体容量较大,约10 kb,但是会持久表达Cas9,加强脱靶效应。AdVs和rAAVs具有低免疫原性和非致病性,缺点是容量较小,约4.5 kb,然而CRISPR-Cas9约为8–10 kb。有研究使用两个独立的rAVVs包装CRISPR-Cas9,但这种设计会影响CRISPR-Cas9技术的效率。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
4、免疫排斥
CRISPR-Cas9技术来源于原核生物天然获得性免疫系统,人类本身不具有Cas9蛋白,并且存在Cas9抗体,在基因治疗的过程中,外源性的蛋白以及病毒载体的导入会使机体产生免疫排斥,这必然会让研究者考虑到安全性的问题。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
5、副作用
2018年有报道称CRISPR-Cas9高效编辑的同时伴随着人类p53基因的功能抑制,然而p53基因是人体重要的抑癌基因,这会增加癌细胞的逃逸机会,或让基因编辑过的细胞成为潜在癌细胞。另外,在2018年7月还有研究团队通过第三代测序技术大范围的基因型鉴定,发现CRISPR-Cas9会导致靶点附近大段基因组片段的丢失,甚至还有DNA重排问题,但是这个问题仅在细胞中出现,胚胎水平还没有相应大片段丢失的报道。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
5、伦理问题
目前,国内外对基因编辑的边界和红线都达成了共识,对胚胎发育阶段或生殖系细胞进行体外基因编辑的研究是被允许的,但绝不能用于生殖的目的,而且其研究的过程需要政府主管部门进行严格的监管,流程需要公开透明。
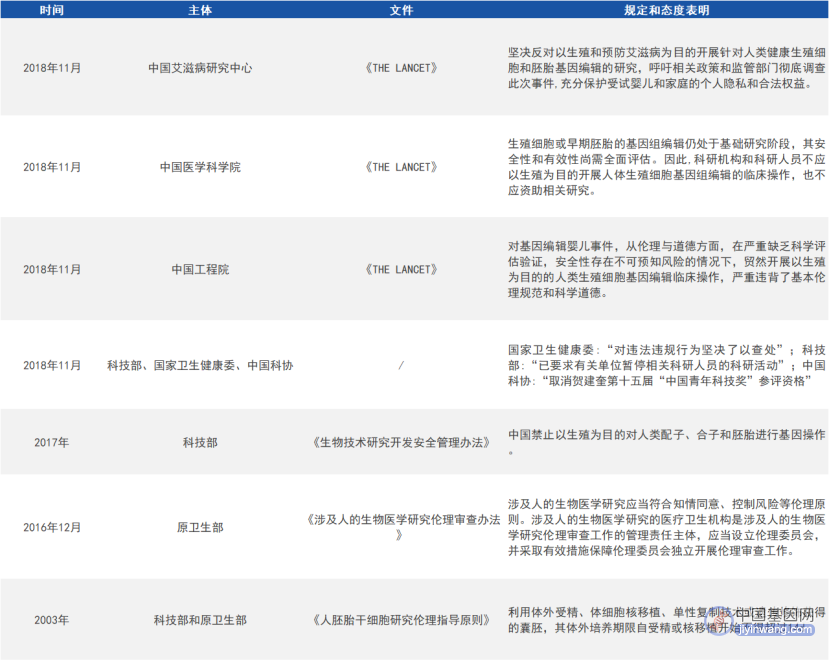
国内对基因编辑技术的伦理规范及态度声明(来源:参考资料1)
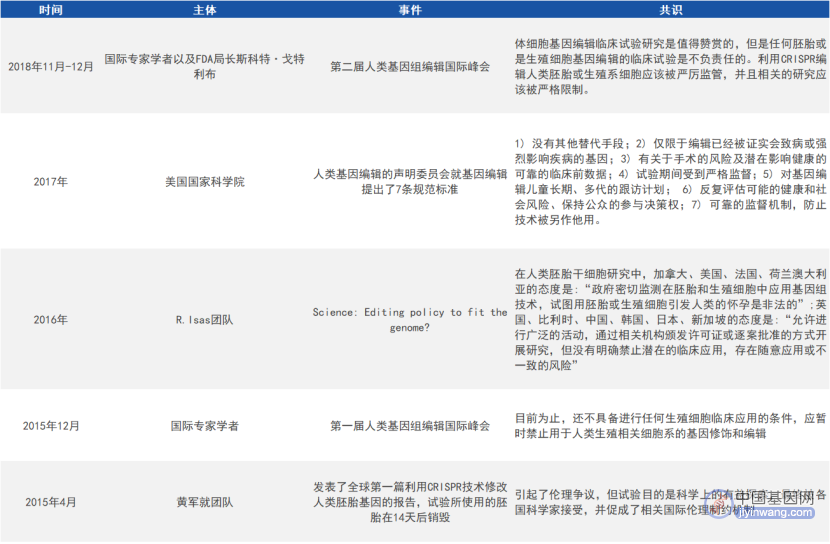
国外对基因编辑技术的伦理规范(来源:参考资料1)
四、
基因编辑技术国内外相关政策与规划
作为一项变革性的新兴技术,基因编辑研究和临床试验是新鲜事物,各国都没有现成的监管经验,在技术监管和风险防控上均保持较高的谨慎态度。近年来,多国围绕人类基因编辑发布了一系列报告,初步构建了基因编辑政策框架。
1. 中国
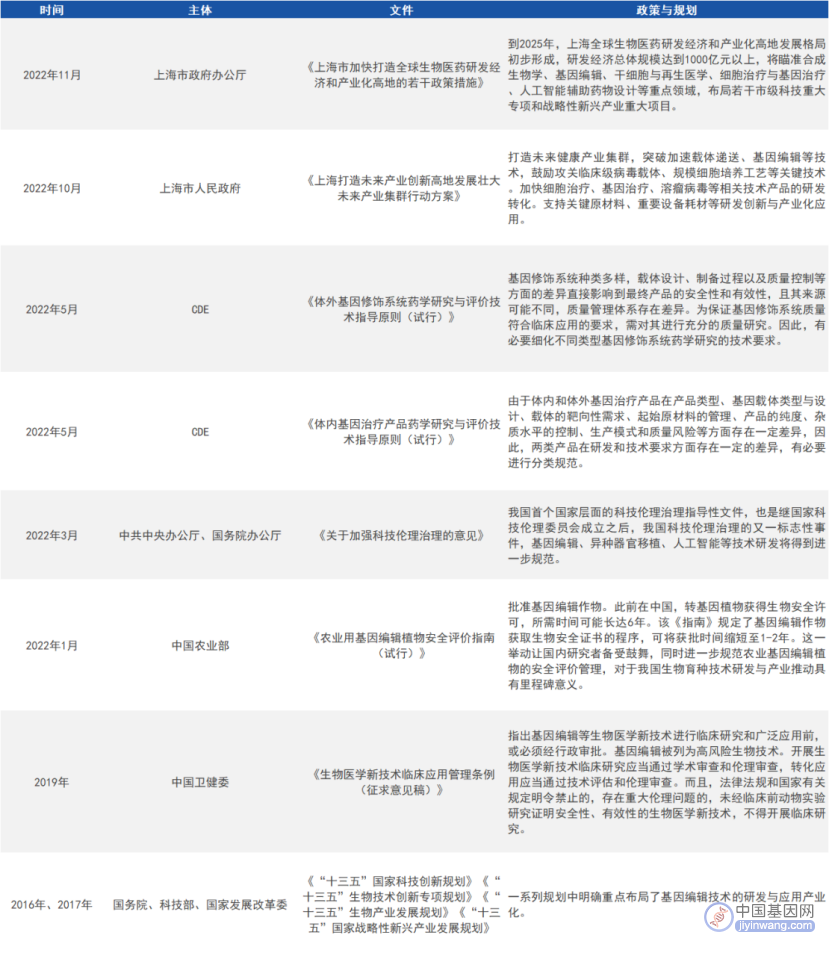
来源:公开资料
2. 美国
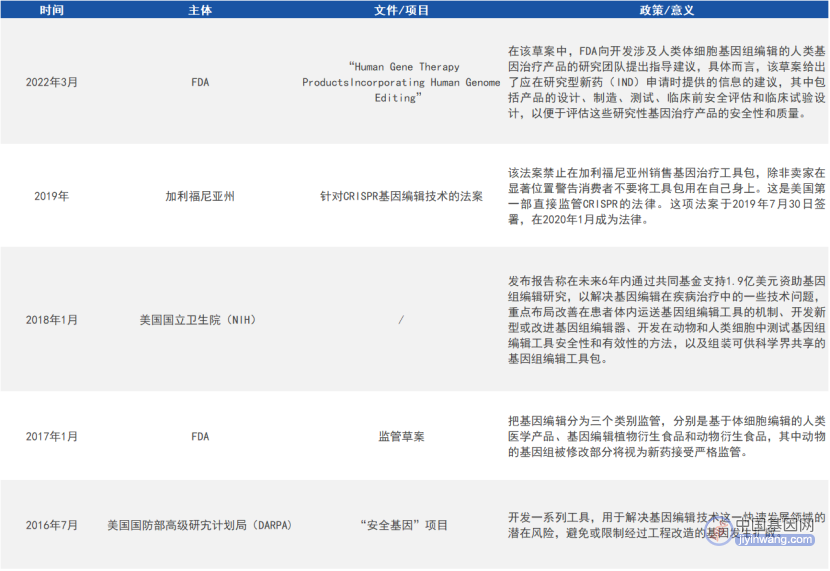
来源:公开资料
3. 科研共同体及其他国家

来源:公开资料
五、
基因编辑技术的临床应用
近年来,不断涌现的研究成果证实了基因编辑在临床治疗中的广阔前景,如利用TALENs治疗杜氏肌营养不良(DMD)、HIV;ZFNs治疗帕金森(PD);TALENs或ZENs都有望治疗大疱性表皮松解疾病和α1-抗胰蛋白酶缺陷症;TALENs或CRISPR-Cas9治疗镰刀型细胞贫血症,CRISPR-Cas9治疗遗传酪氨酸血症、白内障等。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
1、罕见病
罕见病又称为“孤儿病”,大多病情严重且无有效治疗办法。80%的罕见病由遗传变异所引起,多为单基因遗传病。单基因遗传罕见病结合精准医疗可更为轻易地识别患者,靶点明确,是基因疗法最具潜力的病种,如遗传性血液病、杜氏肌营养不良症(DMD)等。
1.1 遗传性血液病
在红细胞中,血红蛋白负责运输氧和二氧化碳,由两条类α珠蛋白链(α链或ξ链)和两条类β珠蛋白链(β链、γ链或ε链)各结合一个血红素组成。珠蛋白基因突变会引起血红蛋白病,包括血红蛋白变异体和地贫,前者受累于血红蛋白结构异常,后者则由于α链或类β链合成数量减少/缺失,致使另一条珠蛋白链含量相对过剩并沉积于红细胞膜,进而引发溶血,严重可导致胎儿流产和患儿死亡。根据减少/缺失的珠蛋白链的不同,地贫可分为α-地中海贫血(α-地贫)、β-地中海贫血(β-地贫)等。
血友病是由凝血因子基因突变导致相应凝血因子严重缺乏而引起的出血性疾病,其中血友病A和血友病B最常见且均为X连锁隐性遗传病,分别由于凝血因子VIII基因(factorVIII,FVIII)和凝血因子IX基因(factorIX,FIX)突变而引起。
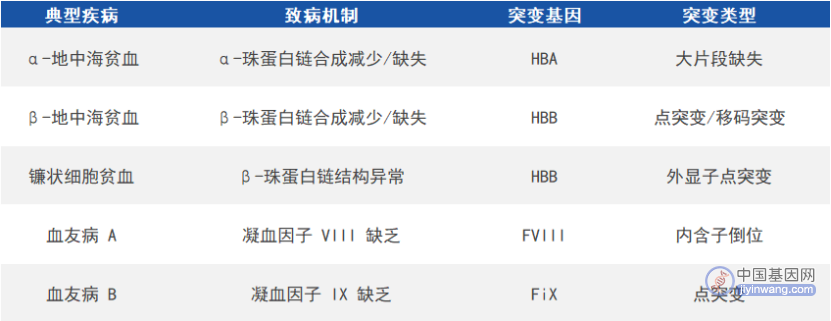
常见遗传性血液病(来源:参考资料8)
对于上述遗传性血液病,临床上主要采取长期规范输血、成分输血等方法进行对症治疗。这些短效的对症疗法无法根治遗传性血液病,且长期反复输血会导致铁沉积,还可能引发感染和过敏反应,甚至导致死亡。少部分患者可通过异体骨髓或造血干细胞移植获得长效/永久的治疗效果,但存在供体缺乏和免疫排斥等问题,且费用昂贵。随着现代基因编辑技术的进步,基因治疗成为具有巨大前景的治疗方案,有望根治遗传性血液病。
1.2 杜氏肌营养不良症(DMD)
DMD是X染色体p21.2上抗肌营养不良蛋白(dystrophin)基因突变引起的最常见和最严重的肌营养不良症,这种突变导致患者肌肉中缺少dystrophin,特征是进行性肌肉退化和萎缩,导致心肌病和呼吸衰竭而过早死亡。dystrophin是X染色体编码的最大基因,包含约260万个碱基和多达79个外显子,在人类已经发现了超过3000种不同的突变。该疾病是最常见的单基因遗传性疾病之一,也是如今大热的基因治疗领域中最受关注的疾病之一,因为其致病基因十分明确,有且只有一个——dystrophin。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
2、神经退行性疾病
神经退行性疾病是机体神经元结构或功能逐渐丧失而引发的一类疾病,目前由于病因尚不明确并无有效治疗手段,且严重威胁着患者的生活质量。基因疗法可以将外源正常基因导入靶细胞,以纠正或补偿因基因缺陷和异常引起的神经退行性疾病,如脊髓性肌萎缩症(SMA)、帕金森(PD)等。
2.1 脊髓性肌萎缩症(SMA)
SMA是一种罕见的遗传性神经肌肉疾病,以脊髓和下脑干中运动神经元的丢失为特征,从而导致严重的、进行性肌肉萎缩和无力。最终,SMA患者可能丧失行走能力,并且难以完成呼吸和吞咽等基本生活功能,需要重大的医疗干预和护理帮助。如果不进行治疗,大多数患有最严重类型SMA的婴儿在没有呼吸干预的情况下,无法活到两岁。
SMA由运动神经元存活(SMN)基因丧失功能突变致病,人的SMN在每条5号染色体上均有2个高度同源且编码相同蛋白的拷贝,即端粒端的SMN1和着丝粒端的SMN2,两者只相差5个碱基,其中编码序列仅相差1个碱基,即7号外显子的第6个碱基C/T(840C/T)。由于C的改变,使SMN2产生了选择性剪切,转录产物中90%缺少7号外显子,翻译成截短且不稳定的SMN蛋白。
临床上绝大部分SMA患者是由SMN1基因大片段缺失或微小突变导致,而几乎全部SMA病人都含有至少一个SMN2拷贝,因此SMN2一直是SMA治疗的理想靶标。
2.2 帕金森(PD)
帕金森病是世界上第二常见的神经退行性疾病,目前没有中止疾病进展的有效治疗手段。编码α突触核蛋白的SNCA基因上的突变是治疗帕金森病的重要靶点之一。而且,越来越多的证据显示,α突触核蛋白水平的升高与帕金森病的发病有因果性关系。SCNA基因调控失常的患者α突触核蛋白的表达水平可提高200%,将SCNA的mRNA和蛋白表达降低25~50%可能就足以将α突触核蛋白的表达水平恢复正常。
Seelos Therapeutics公司的创新表观遗传学基因编辑疗法SLS-004,通过调节DNA甲基化来调控编码α突触核蛋白的SNCA基因的表达。SLS-004使用CRISPR-dCas9引导的DNA甲基转移酶3A(DNMT3A),利用慢病毒在脑内递送,在SNCA基因内含子1的特定位置提高DNA甲基化,从而精准地降低SNCA的表达。此前在体外实验中,SLS-004可导致α突触核蛋白水平降低~40%。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
3、年龄相关性黄斑衰退(AMD)
AMD是导致成人失明的主要原因,脉络膜新血管形成(CNV)是其主要病理学特征,血管生成因子如VEGFA基因的高表达是造成病变的主要原因。
Kim等将预先设计好的Cas9核糖核蛋白(RNP)导入成年小鼠眼中,使视网膜色素上皮中VEGFA基因失活;并且在AMD的小鼠模型中发现cas9RNPs有效地减少了脉络膜新血管生成的面积。该研究表明CRISPR-Cas9技术有可能用于非遗传性退行性眼部疾病的局部治疗。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
4、1型糖尿病(T1D)
T1D是自身免疫性疾病,是一种因体内胰岛素分泌不足,或人体无法有效地利用胰岛素而导致的慢性病。胰岛素是胰腺细胞分泌的一种调节血糖的荷尔蒙,主要参与调节血糖水平。
T1D患者免疫系统攻击并摧毁机体正常产胰岛素的胰岛β细胞,机体因胰岛素缺乏不能清除多余葡萄糖维持机体正常血糖水平,血糖升高,患者终生需要外源性胰岛素治疗。
基因编辑技术公司CRISPR Therapeutics和再生医学公司ViaCyte合作开展的VCTX210 治疗1型糖尿病的Ⅰ期临床试验正在进行中,目前已经完成首位患者给药。VCTX210利用CRISPR技术敲除与T细胞供给相关的基因对干细胞进行基因编辑,分化出胰腺细胞移植入患者体内,使其逃避患者免疫系统的识别,重塑胰岛细胞的正常分泌过程。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
5、艾滋病(HIV)
艾滋病(AIDS,获得性免疫缺陷综合征)病毒,是造成人类免疫系统缺陷的一种病毒。1983年,HIV在美国首次发现。它是一种感染人类免疫系统细胞的慢病毒(lentivirus),属逆转录病毒的一种。HIV通过破坏人体的T淋巴细胞,进而阻断细胞免疫和体液免疫过程,导致免疫系统瘫痪,从而致使各种疾病在人体内蔓延,最终导致艾滋病。由于HIV的变异极其迅速,难以生产特异性疫苗,至今无有效治疗方法,对人类健康造成极大威胁。
第一次在人类中应用靶向核酸酶是利用ZFNs技术编辑CCR5基因抵抗HIV。研究者从HIV病人中提取T细胞,用ZFNs技术干扰T细胞中CCR5基因,由于CCR5基因是大部分HIV菌株尤其是早期感染菌株的辅助受体,干扰CCR5基因的表达可以抗HIV感染,表明基因编辑技术可能成为艾滋病治疗的新方向。
近年来,随着对基因编辑技术的不断探索,多种高效新型核酸酶的发现使基因编辑技术发生了质的飞跃。
6、肿瘤
肿瘤发生是一个复杂的过程,涉及多基因和多阶段的变化,包括原癌基因激活、抑癌基因失活,以及微缺失、微重复、重排和染色体结构异常等。免疫疗法是目前肿瘤治疗的主要方式之一,其利用具有抗肿瘤功能的单克隆抗体或者供体T细胞,靶向自身免疫系统。在肿瘤的演变过程中,会出现免疫逃逸现象,即机体免疫系统无法识别肿瘤细胞特异性抗原,使其逃过免疫监视。基因编辑与免疫疗法相结合,可重新恢复对肿瘤细胞的免疫监视功能,以清除肿瘤细胞,该方法在白血病、淋巴瘤和部分实体瘤中有巨大的发展前景。
人工改造的具有嵌合抗原受体的T细胞(CAR-Tcells)具有肿瘤细胞特异性抗原嵌合结构域,可激活T细胞,实现对肿瘤细胞的杀伤作用。Ren等使用CRISPR-Cas9系统同时破坏多个基因位点,产生的TCR和HLA-I缺陷的CAR-T细胞可作为通用的CAR-T细胞,用于免疫治疗;除了产生通用的CAR-T细胞,基因编辑技术也可通过敲除编码T细胞抑制受体或信号分子的基因如PD-1和CTLA4,用于产生增强型CAR-T细胞。
2016年,四川大学华西医院卢铀团队开展了CRISPR基因编辑技术的临床实验,从转移性非小细胞肺癌患者中分离出T细胞,并使用CRISPR-Cas9技术敲除细胞中的PD-1基因,在体外扩增到一定量后再重新输回患者体内,达到杀死肿瘤细胞的目的。这是世界首例基因编辑细胞人体注射。2020年,该临床试验结果公布,该结果证实了CRISPR-Cas9基因编辑的T细胞临床应用是安全可行的。
随着测序技术的发展,越来越多与肿瘤发生发展相关的突变基因被鉴定出来。CRISPR-Cas9系统高效、特异的基因编辑功能,为直接靶向生物体内引发癌变的突变基因提供了可能。基于CRISPR-Cas9系统的个体化靶向治疗,在基因水平的肿瘤治疗中显示出的巨大潜力,也为肿瘤治疗提供了新方向。
六、
小结
从1996年对ZFNs第一次进行体外验证到2012年CRISPR-Cas9技术的出现和以后的蓬勃发展,基因编辑技术发展迅速,编辑效率和精确性都在不断提高,应用领域也在不断拓宽。不仅可用于表达调控和基因功能的研究、细胞动物模型的构建、癌基因和药物靶点的筛选,而且在基因治疗中更是为单基因遗传病、癌症等疾病提供了新的治疗方法。
虽然目前这项技术在成熟应用之前仍然面临着递送系统、脱靶效应以及潜在的免疫反应等副作用的问题。但总体来看,基因编辑技术在临床应用、分子育种及合成生物学等产业发展潜力巨大,将会带来较高的社会价值与经济价值。该技术的临床转化和应用研究值得我们期待,这或将成为下一代转化疗法和治疗范例的关键,并促进个体化医疗的快速发展。
另外,对于目前基因编辑技术的关键问题,我们相信在未来多学科的交叉融合和科学家的共同合作下,也将会一一得到解决。
参考资料:
1.刘耀,熊莹喆,蔡镇泽,张冰.基因编辑技术的发展与挑战[J].生物工程学报,2019,35(08):1401-1410.DOI:10.13345/j.cjb.180532.
2.行业分析|基因编辑:上帝的手术刀,将为我们带来怎样的技术与市场机遇?
3.一文告诉你,基因编辑技术的“进化”之路
4.生物医药科技前沿—基因疗法(三):基因编辑技术
5.ZFN, TALEN and CRISPR/Cas-based methods for genome engineering,DOI:10.1016/j.tibtech.2013.04.004
6.陈一欧,宝颖,马华峥,伊宗裔,周卓,魏文胜.基因编辑技术及其在中国的研究发展[J].遗传,2018,40(10):900-915.DOI:10.16288/j.yczz.18-195.
7.陈云伟,陶诚,周海晨,张志强.基因编辑技术研究进展与挑战[J].世界科技研究与发展,2021,43(01):8-23.DOI:10.16507/j.issn.1006-6055.2021.01.002.
8.探针资本_行业研究:基因编辑
9.卢俊南,褚鑫,潘燕平,陈映羲,温栾,戴俊彪.基因编辑技术:进展与挑战[J].中国科学院院刊,2018,33(11):1184-1192.DOI:10.16418/j.issn.1000-3045.2018.11.006.
10.行业洞察|一文看懂基因编辑
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。