Nature重磅:揭开人类基因组中这种古老遗传元件的入侵、移动和致病机制

数十亿年前,当原始生命形式开始变得更加复杂时,一个自私的遗传元件成为了一种基因组“殖民者”。它们通过复制和粘贴,不断将自己整合到各种各样的基因组中。随着时间的推移,所有真核生物都继承了这些序列,包括我们人类。事实上,这个古老的遗传元件占据了大约三分之一的人类基因组,这些序列此前一直被认为是没有作用的“垃圾DNA”,也被称为黑暗基因组(dark genome)。
黑暗基因组主要由重复元件或重复序列组成,这些重复序列包括不同家族,例如LINE(长散在重复序列,占21%)、SINE(短散在重复序列,占15%)、Alu元件和HERV(人内源性逆转录病毒,占9%)等等。在健康的成人细胞中,这些重复序列处于休眠状态。然而,在疾病或细胞应激的情况下,这些重复序列可以被激活。激活的重复序列可以转录成RNA并翻译成蛋白质,这可能会产生促进疾病的下游效应,例如加剧我们的免疫系统激活、帮助肿瘤生长和增殖。
LINE-1是一个普遍存在于黑暗基因组中的转座子家族,人类基因组包含了大约50万个LINE-1拷贝,占人类基因组的17%,其中约100个是活跃的,它们编码了功能性逆转录酶(RT)。当它们异常表达时,LINE-1 RT在细胞质中将RNA逆转录为DNA,通过核酸传感器触发病毒模拟反应,这导致驱动自身免疫性疾病的1型干扰素和NF-κB通路的激活。一种名为ORF2的蛋白质是LINE-1能够成功的关键,这意味着了解ORF2p的结构和机制可能为多种疾病提供新的潜在治疗靶点。
近日,Rome Therapeutics联合哈佛医学院麻省总医院、格罗宁根大学医学中心、威尔康奈尔医学院、罗格斯大学、洛克菲勒大学、阿尔伯特大学、Dana Farber癌症研究所等机构的研究人员,在 Nature 期刊发表了题为:Structures, functions, and adaptations of the human LINE-1 ORF2 protein 的研究论文【1】。
该研究首次高分辨率地呈现了ORF2蛋白的核心结构,揭示了LINE-1关键致病机制的许多新见解。这项将促进靶向LINE-1的药物设计,并可能带来新的治疗方法和策略来对抗癌症、自身免疫疾病、神经退行性疾病和其他衰老相关疾病。

Nature 同期还发表了来自加州大学伯克利分校的题为:Template and target site recognition by human LINE-1 in retrotransposition 的研究论文【2】。该研究同样解析了LINE-1表达的全长ORF2蛋白的结构,并揭示了其在人类基因组中复制和转移的机制。

LINE-1是一种逆转录转座子,它能够将RNA逆转录回DNA,同时复制和写入生物体的基因组中的不同位置。目前我们还不清楚LINE-1的起源,但它与II型内含子有进化联系,这是一种可追溯到约25亿年前的古老的可移动元件。像LINE-1这样的逆转录转座子已经与其宿主生物体一起进化了10-20亿年,这是LINE-1试图插入自己和宿主保护其基因组之间的一场持续战斗。
在人类细胞中,存在着大约50万个LINE-1拷贝,占人类基因组的17%,其中绝大多数是无活性的,这是它们劫持复制机制失败的证据。但其中约有100个是活跃的。该研究团队十多年来一直致力于研究LINE-1及其表达的蛋白质,但由于ORF2蛋白表达水平低且不频繁,因此对其了解仍然很有限。
论文共同通讯作者 John LaCava 教授表示,LINE-1一直很难研究,因为它有非常奇怪的特征,例如,它有一个不寻常的复制周期,并且一直没能能够捕获ORF2蛋白。但我们最终纯化到了全长ORF2蛋白以及促进LINE-1复制的核心,这让我们得以进一步解析其结构。
通过将X射线晶体学和冷冻电镜这两种结构解析技术的结合,研究团队发现了ORF2蛋白核心内两个新的折叠域,它们有助于LINE-1的自我复制能力。ORF2蛋白具有独特的结构适应性,它是一种多面手蛋白质,能够处理从序列的复制到插入的所有事情。大多数病毒需要潜在的数百个逆转录酶蛋白质来实现复制,而ORF2蛋白可以完成这些所有工作。
当LINE-1在细胞质中被激活时,它就像一个病毒模拟物。它会产生RNA:DNA杂交链,当它们被细胞免疫系统感知时,看起来就像是病毒感染,这种病毒模拟可能为ORF2蛋白如何激活固有免疫系统,导致自身免疫疾病和其他疾病提供了一个可能的解决方案。该研究进一步发现,与细胞质中遗传物质的相互作用激活了cGAS/STING抗病毒通路。反过来,该通路导致细胞产生干扰素,刺激免疫系统并导致炎症,类似于病毒感染时发生的情况。
具体来说,研究团队使用X射线晶体学和冷冻电镜解析了人类ORF2蛋白的“核心”(残基238-1061,包括逆转录酶结构域)的多种构象状态的结构。,揭示了其两个新的折叠域,可与RNA模板的广泛接触,以及相关适应性,这些都有助于LINE-1复制周期的独特方面。 全长ORF2蛋白的计算整合结构模型显示了一个动态的闭环构象,在逆转录转座过程中似乎打开。研究团队还对ORF2蛋白逆转录酶抑制进行了表征,并揭示了其潜在的结构基础。成像和生物化学揭示了非经典的胞质内ORF2蛋白逆转录酶活性可以产生RNA:DNA杂交链,通过cGAS/STING激活固有免疫信号通路,导致干扰素的产生。
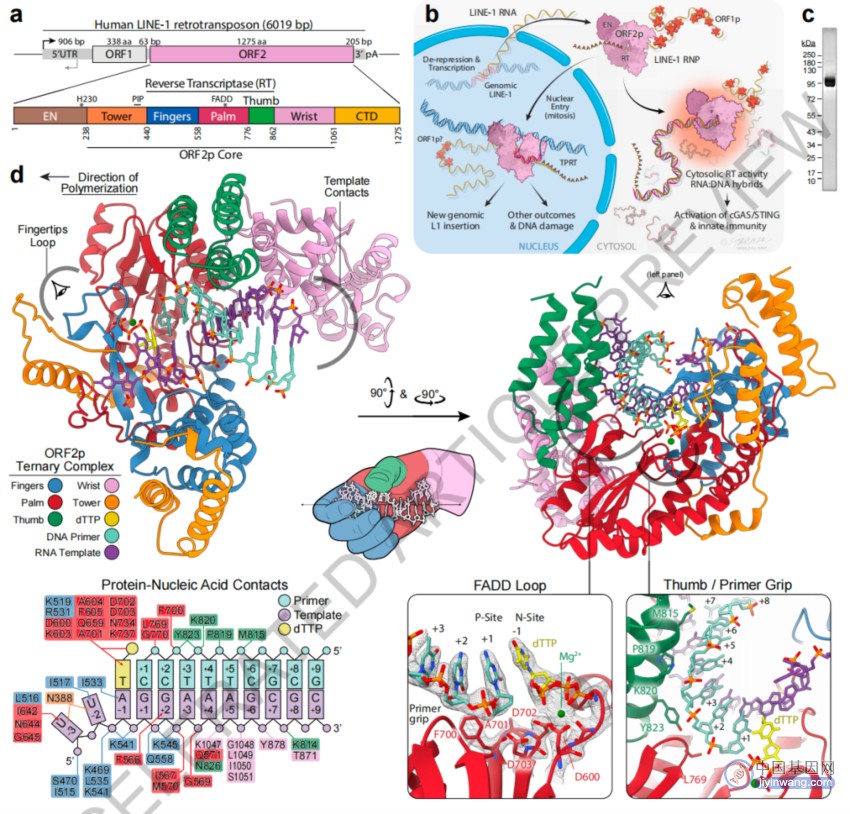
LINE-1的致病复制周期和人ORF2蛋白核心的2.1埃分辨率晶体结构
与逆转录病毒的逆转录酶相比,LINE-1的逆转录酶可以由短RNA和发夹RNA高效启动,这可能解释了其胞质内启动。该研究还通过进化分析揭示了ORF2蛋白和其他RNA和DNA依赖性聚合酶之间的结构保守性。 这些研究提供了LINE-1聚合和插入的关键机制见解,揭示了其进化史,并使靶向LINE-1的药物开发变得更加合理。
研究团队还测试了针对逆转录病毒HIV和HBV的治疗方法,以了解它们是否会抑制LINE-1。结果显示没有,这表明必须针对LINE-1的独特特征进行定制的抑制方法。这项研究为更好地设计LINE-1抑制剂打开了大门。
值得一提的是,Rome Therapeutics 近日公布了他们的一款同类首创药物——RPT-A的临床前研究数据,该药物旨在通过抑制LINE-1来控制自身免疫疾病,目前正在进行临床试验申请。实验数据显示,该药物能够有效地减少自身免疫性疾病(红斑狼疮)小鼠模型中的致病性的自身抗体,他们还展示了来自人类研究的数据,证明了LINE-1 RT是一个可行的药物靶点。
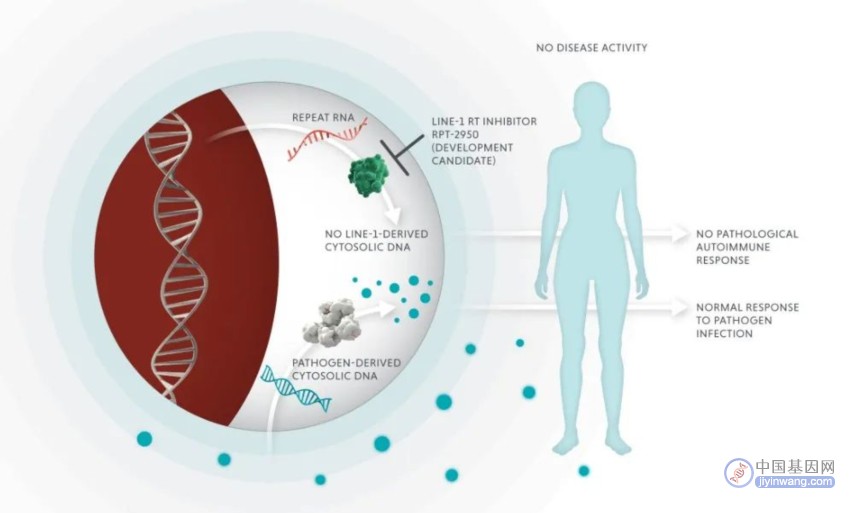
Rome Therapeutics首席执行官 Rosana Kapeller 博士表示,这些数据首次证实LINE-1 RT是一种新的治疗靶点,可用于广泛的自身免疫性疾病的潜在治疗干预。这些数据也标志着公司的重大里程碑。

论文链接:
1. https://www.nature.com/articles/s41586-023-06947-z
2. https://www.nature.com/articles/s41586-023-06933-5
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。