当爹要趁早!Nature研究:父亲年龄越大,传递给后代的基因突变越多!
随着社会的发展,生活水平不断提高的同时,晚婚晚育的现象也日渐普遍。提到“生育年龄”,人们第一反应总联想到女性,“高龄产妇”、“女性最佳生育年龄”是热点话题。男性在生殖过程中担任的角色总会在一定程度上被忽视,其实男性也有“最佳生育年龄”。那么男性生育年龄较大,对后代会有什么影响呢?

近日,Nature Ecology & Evolution杂志发表一篇题为“Transcriptional and mutational signatures of the aging germline”的研究论文[1],发现与年轻雄性果蝇相比,年长雄性果蝇可能会给后代传递更多的新生基因突变,可能与年长果蝇在精子发生过程中清除突变的能力较差有关。

来自洛克菲勒大学进化遗传学与基因组学实验室的研究团队将雄性果蝇作为实验对象,将实验对象分为两组,羽化后48小时的果蝇为“年轻组”,羽化后25天的果蝇为“年长组”。研究者对两组果蝇的睾丸生殖细胞进行了单细胞RNA测序,同时对体细胞组织进行了基因组测序(DNA测序)。需要说明的是,体细胞是一个相对于生殖细胞的概念,体细胞的遗传信息不会像生殖细胞那样遗传给下一代。
本研究使用Seurat 4[2],将生殖细胞分为6种类型,根据精子发生的过程依次列出:生殖系干细胞(GSC )/早期精原细胞、晚期精原细胞、早期精母细胞、晚期精母细胞、早期精子细胞和晚期精子细胞。
研究者通过单细胞 RNA 测序推断基因组突变,然后将它们与基因组数据进行比较,将突变与它们发生的细胞类型相匹配。如果这种突变不存在于同一只果蝇体细胞的 DNA 中,则判定为这是一种新生突变(de novo mutation)。
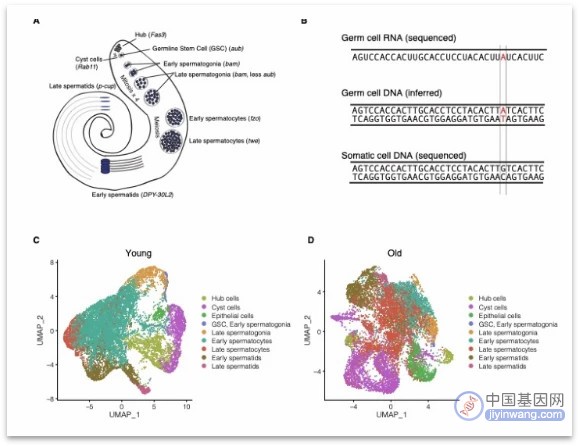
图:实验设计和可视化概述(来源:[1])
年老的果蝇在精子发生过程中
表现出突变修复过程受损
为了评估年轻组和年长组果蝇之间的突变负担,研究者比较了每种细胞类型中至少检测到一种突变的细胞比例。结果发现,在GSC/早期精原细胞中,与年轻组果蝇相比,年长组果蝇的突变细胞比例稍高,但在统计上十分相似,均约50%的GSC/早期精原细胞至少有一种新生突变。但在随后的细胞类型中分化明显,年轻组果蝇晚期精子细胞只有8%发生突变,年长组果蝇晚期精子细胞40%发生突变!
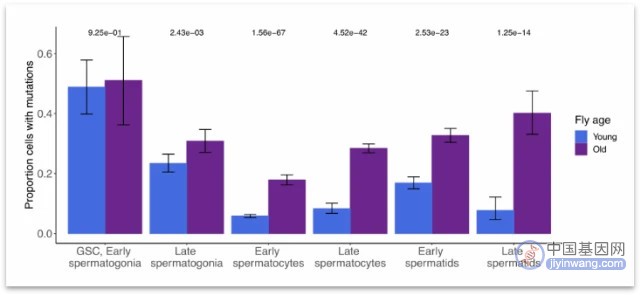
图:年长组果蝇生殖细胞突变修复受损(来源:[1])
年老果蝇T>A突变显著增加
研究者比较了年轻组果蝇和年长组果蝇6种突变类型的比例,发现在年轻组果蝇中主要发生T>G和T>C突变。而在年长组果蝇中,突变类型主要为T>A突变。这提示在精原细胞产生过程中可能存在与年龄相关的突变偏倚或基因突变修复偏倚。那么这些突变特征的差异的原因是什么呢?研究者进一步研究发现,在年长组果蝇的GSC/早期精原细胞中基因组维持基因的表达显著低于年轻组果蝇,表明可能是年长组果蝇中基因组维持基因的低活性影响了突变偏倚。
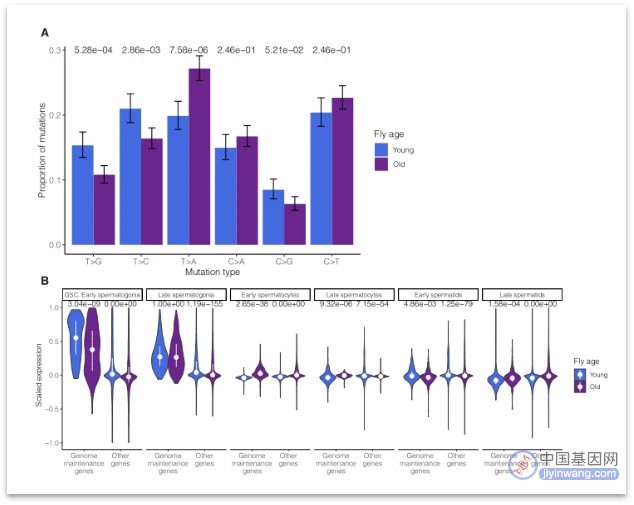
图:突变特征和基因组维持基因表达的年龄相关趋势(来源:[1])
果蝇早期生殖细胞基因组维持基因上调
随后,研究者对211个与DNA损伤修复相关的基因进行了差异表达测试。发现在年轻组果蝇GSC/早期精原细胞中24个DNA损伤反应基因显著富集,而在年长组果蝇中仅有4个基因富集,基因组维持基因表达不足可能会影响精子发生过程中的修复效率。
紧接着,研究者发现年轻组果蝇GSC/早期精原细胞中富集的主要是RNA聚合酶亚基或参与转录的一些基因。这表明,年长组果蝇的突变特征可能是由转录偶联修复缺陷引起的。
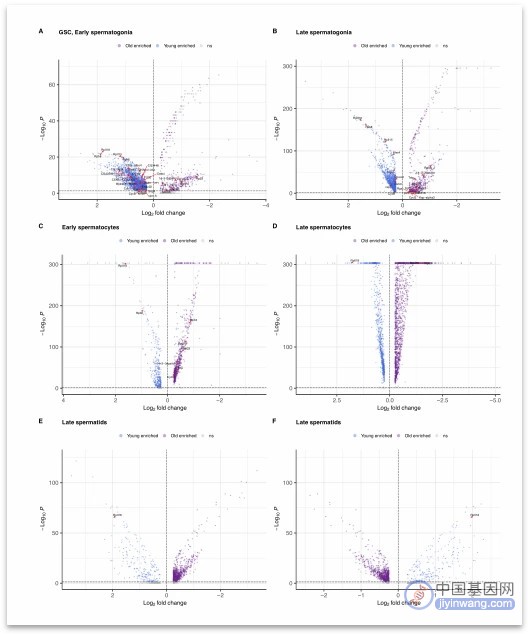
图:基因组维持基因的年龄相关差异表达(来源:[1])
晚期生殖细胞富集基因dN/dS值较早期更高,年轻组果蝇富集基因dN/dS值较年长组更高
研究者通过比较dN/dS值,探究了衰老过程中基因表达的失调对进化是否存在影响。首先,我们了解一下dN/dS值是什么,简单来说,dN/dS值越大越好,即正向选择占主导地位,有害突变占比越小。
结果发现,在年轻组和年长组果蝇中,晚期生殖细胞富集基因比GSC/早期精原细胞富集基因具有更高的dN/dS值,这一结果表明精母细胞和精子细胞是快速进化或正向选择的来源,突出了晚期精子发生在转录和功能创新中的重要性。出乎意料的是,在相似的细胞类型中,与年长组果蝇相比,年轻组果蝇细胞中富集基因dN/dS更高,提示年轻果蝇比年长果蝇具有更大的进化优势。
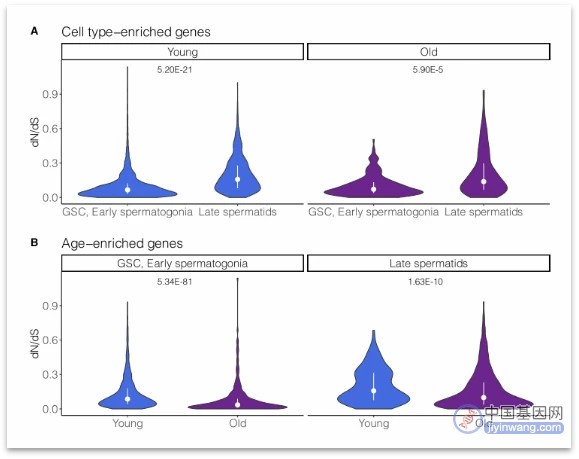
图:细胞型富集基因和年龄富集基因的dN/dS变化趋势(来源:[1])
综上所述,该研究为男性生殖细胞的转录和突变特征提供了新的见解,值得注意的是,该研究中的突变是针对转录本的检测,然而不同细胞间存在差异,后续可通过同时对单个细胞进行RNA-seq和全基因组测序排除该因素的影响,并且该研究结果在人类身上是否适用也值得进一步研究。
参考文献:
[1] Witt, E., Langer, C.B., Svetec, N. et al. Transcriptional and mutational signatures of the Drosophila ageing germline. Nature Ecology & Evolution (2023).
[2] Satija, R., Farrell, J.A., Gennert, D., Schier, A.F., and Regev, A. (2015). Spatial reconstruction of single-cell gene expression data. Nat. Biotechnol. 33, 495–502.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。