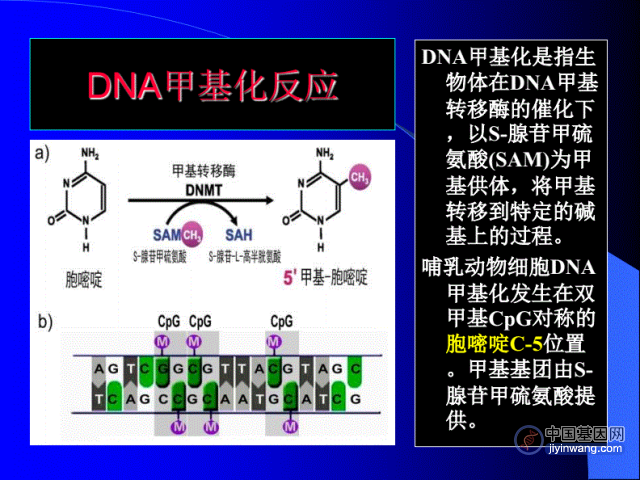
基因组编十周年,CRISPR技术发展的前世今生
三年前,科学家报道了CRISPR技术,该技术能精确、有效地在活的真核细胞中对基因组进行编辑。自那以后,该方法以风暴般的速度席卷了整个科学界,从生物医药到农业领域,有数以千计的实验室采用了该方法进行研究。然而,这项研究的发现和发展历程:从发现一种陌生的微生物重复序列开始,到被认为是一种适应性免疫系统,随后其生物学特性为人们所了解,到最后开发成基因工程技术,并不为多数人知晓。今天,就带大家走进CRISPR的历史,了解它的前世今生。
概要
CRISPR可以说是一种革命性的技术,没有任何一种技术能如CRISPR这般快速横扫整个生物学界。三年前,科学家报道了CRISPR系统,这是一种适应性免疫系统,微生物利用该系统可以防止病毒入侵,通过记录和靶向病毒DNA,来不动声色地切除病毒基因。在活细胞、哺乳动物基因组和其他器官内,可以将CRISPR系统发展成一种简单、可信的编辑技术。该技术随后被广泛应用,如:创建了复杂的人类遗传疾病和癌症的动物模型、开启或关闭某个基因等。CRISPR技术可能用于修饰人类生殖细胞系的前景也在国际上引起了争论。
几乎所有的分子生物学家都听说过CRISPR技术。但是,真正知道这场革命是如何发生的人却寥寥无几。科学家只关注该技术的未来应用,至于这项技术是如何发现的,并不是他们关注的内容。发现过程往往只是普通人茶余饭后的谈资而已。但是,科学发展背后的故事能带来更多的灵感,让科研人员对于驱动着生物医学进步的、令人惊讶的生态系统有更深的了解。那么,现在就来了解CRISPR技术的前世今生,以及CRISPR技术的榜上英雄。
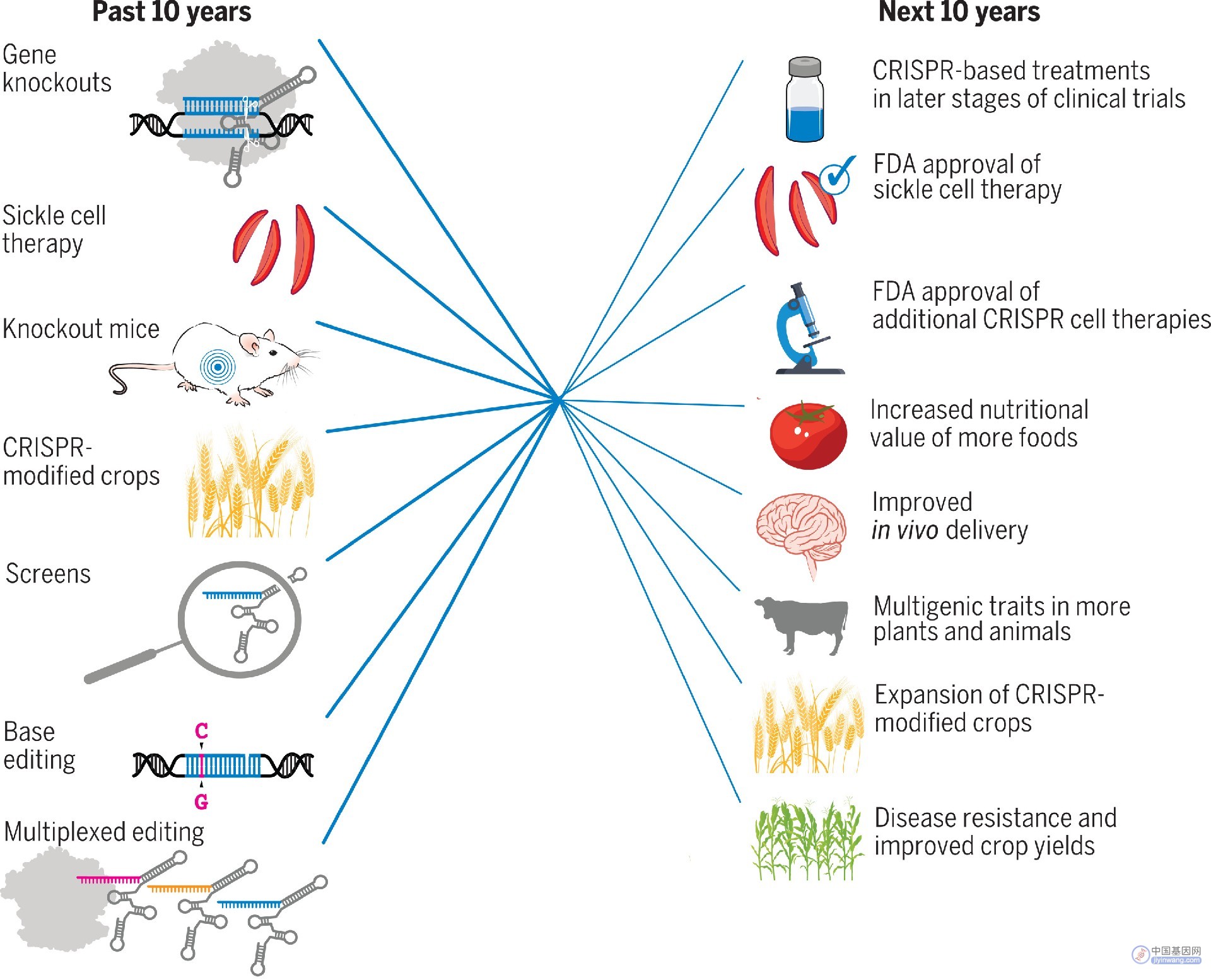
CRISPR技术的发现
第一个故事发生在西班牙科斯塔布兰卡(Spain’s Costa Blanca)的地中海港口圣波拉(Santa Pola),那里有美丽的海岸和广阔的盐沼,几个世纪以来吸引了众多的游客、盐商还有火烈鸟。Francisco Mojica就在附近长大,经常在海岸边出入,因此,在1989年,他在位于海岸边的阿利坎特大学读博士时,选择在实验室进行极嗜盐菌属(Haloferax mediterranei)的研究工作就毫不意外了。Haloferax mediterranei是一种从圣波拉沼泽中分离出的极端耐盐性的古细菌。他的导师发现,培养基的盐浓度会影响限制性内切酶切割微生物的基因组的方式。Mojica开始研究改变了的片段的特征。在他研究的第一个片段里,Mojica发现了一种稀奇的结构:一种近乎完美的重复序列,该序列与任何已知的微生物家族中的重复序列都不同。这个28岁的学生被深深吸引,在他职业生涯之后的十年里,他都在试图解开这一谜团。他很快发现,在亲缘关系相近的H. volcanii和关系更远的噬盐古菌中有类似的重复序列。通过阅读科学文献,他发现,这可能和真细菌有关。在1987年的一篇文献中,日本团队发现大肠埃希菌中有结构相似的重复序列,但是与极嗜盐菌重复序列并不相似。该文的作者没有继续研究,但Mojica意识到,在关系较远的微生物中出现如此相似的结构对原核生物来说必然意味着一项重要功能。Mojica在去牛津做短期博士后学习之前,于1995年撰写了一篇论文,报道了这一类新的重复序列。
之后,Mojica回到阿利坎特大学担任教员,因为没有启动资金和实验室,他只好通过生物信息学来研究这一奇怪的重复序列,他给重复序列命名为短间隔重复序列(short regularly spaced repeats,SRSRs),随后这个名称在他的建议下进行了更改,命名为成簇的、规律间隔的短回文重复序列(clustered regularly interspaced short palindromic repeat sequences,CRISPR)。到2000年,Mojica已经在20个不同的微生物中发现了CRISPR基因位点,包括结核分枝杆菌、艰难梭菌和鼠疫杆菌。在两年时间里,研究人员对微生物中是否含有这一基因位点进行了普查,并且记录了这一基因座的关键特征。
但是,CRISPR系统的功能到底是什么哪?有人猜想,该系统有不同的功能,包括基因调控、复制子分配、DNA修复和其他的作用。但是这些猜想没有证据支持,都被证明猜错了。就CRISPR的发现而言,最重要的洞察力来自生物信息学。
CRISPR是一个适应性免疫系统
2003年的暑假,Mojica逃离了圣波拉的酷热,躲到了阿利坎特大学的空调房里。截至2003年,Mojica已经成为早期CRISPR领域的大咖级人物,他的研究重点已经由重复序列本身转移到了分离重复序列的间隔序列上。利用文字处理器,Mojica费力地抽出每一个间隔序列并将其插入BLAST程序里,研究其与已知DNA序列的相似性。他进行的这项研究之前从来没有成功过,但是随着DNA序列数据库的不断扩大,这一次他挖到了金矿。在最近一次从大肠埃希菌测序得到的CRISPR基因位点上,其中一个间隔与一种P1噬菌体的序列相匹配,而这一噬菌体可以感染许多大肠埃希菌。然而,携带这一间隔的特殊菌株对P1噬菌体感染具有抵抗力。在那周结束时,他已经找到了4500个间隔。其中有88个间隔序列与已知序列相似,有三分之二的间隔序列与病毒或拼接质粒相匹配。Mojica意识到,CRISPR位点肯定编码了用于适应性免疫系统的一个指令,防止微生物特异感染。
Mojica和同事一起外出庆祝,并在第二天返回办公室撰写论文。因为意识到这项发现的重要性,Mojica将论文投给了《Nature》杂志。2003年11月,《Nature》杂志在没有外部评审的情况下就拒绝了该论文。而且,《Nature》的编辑声称,论文的主要观点已经众所周知。2004年1月,《Proceedings of the National Academy of Sciences》杂志认为该论文缺乏充足的新颖性和重要性,不够资格进行审评。同样,《Molecular Microbiology》和《Nucleic Acid Research》 也相继拒绝了该论文。此时,绝望的Mojica很担心该观点被别人提前发表,所以Mojica把论文投给了《Journal of Molecular Evolution》杂志。经过12个月的评审和修正,报告了CRISPR可能具有的功能的文章最终发表在了2005年2月1日出版的杂志上。
大约同一时间,CRISPR也吸引了另一个人的关注:Giles Vergnaud,人类遗传学家,他的博士和博士后研究受到了法国Direction Générale de l’Armement的资助。1987年,他完成学业,加入政府部门,组建了自己的第一个分子生物实验室。在之后的10年里,Vergnaud继续他的人类基因组研究。但是,到了20世纪90年代后期,情报部门更加关注伊拉克萨达姆政权发展生物武器的情况。在这种情形下,1997年,国防部要求Vergnaud和他的研究团队将研究重心转向法医微生物学,研究可以追踪病原体来源的方法。在联合实验室里,他开始使用串联重复序列多态性方法来绘制炭疽和鼠疫的细菌种类。
法国国防部获得了特殊的、来自1964年至1966年、越南鼠疫暴发期间的61个鼠疫杆菌样本。Vergnaud发现,除了一个位置不相同以外,这些密切相关的分离株在串联重复基因位点上是相同的,不相同的这个位置是由他的同事Christine Pourcel发现的CRISPR基因位点。菌株由于出现新的间隔而偶尔不同,这些间隔常常以极化的形式出现在CRISPR基因位点的前端。值得注意的是,许多新间隔与存在于鼠疫杆菌基因上的原噬菌体相配。他们推断,CRISPR基因位点是作为一种防御机制而存在的,也就是说“CRISPR可能表示了‘过去的遗传攻击’的记忆” 。Vergnaud试图发表论文的过程和Mojica一样,遇到了相同的阻碍。他的论文被《Proceedings of the National Academy of Sciences》、《Journal of Bacteriology》、《Nucleic Acids Research》以及《Genome Research》杂志陆续退稿,直到2005年3月1日才发表于《Microbiology》杂志上。
最后,第三名研究者Alexander Bolotin,是一位俄国微生物学家,他在法国国家农业研究院工作。2005年9月,他的论文发表在《Microbiology》杂志上,论文描述了CRISPR染色体之外的来源。在Mojica的论文发表后一个月,Bolotin的论文才被接收。值得注意的是,Bolotin是第一个提出CRISPR如何提供免疫功能这一设想的研究人员,他推测,来自CRISPR基因位点上的转录物是通过反义RNA抑制噬菌体基因的表达来发挥作用的。尽管这一假设听上去很合理,但是很快就被证实是错误的。
科学发现的三大规律为:公关型、挑战型和机缘型。CRISPR的发现属于机缘巧合,但三位研究者都有备而来。虽然研究结果的发表之路艰难曲折,但是研究人员的坚持不懈最终使得研究结果公之于众。CRISPR的发现只是科研之路的第一步,它的验证及应用才是科研发现的最大价值。
上次说到CRISPR技术榜上的三位英雄,今天我们继续完成以下旅程:了解CRISPR技术的功能与作用。
实验证明CRISPR能提供适应性免疫并能使用核酸酶
像Mojica一样,这几乎是Philippe Horvath选择的最有地方特色的论文题目了。作为一名斯特拉斯堡大学(University of Strasbourg)的博士生,他关注的研究对象是用来腌制泡菜的乳酸菌。鉴于他的兴趣爱好是食品科学,Horvath没有进行博士后研究,而是在2000年末加入了罗地亚(Rhodia)食品公司,一家位于法国西部当热圣罗曼(Dange-Saint-Romain)的细菌发酵培养公司,建立了第一个分子生物实验室。这家公司后来被丹麦公司丹尼斯科(Danisco)收购,而丹尼斯科公司则在2011年被杜邦公司(DuPont)收购。
罗地亚食品公司对Horvath的微生物学特长非常感兴趣,因为其它的乳酸菌,像嗜热链球菌(Streptococcus thermophiles)通常用于生产乳制品,比如酸奶和芝士。Horvath的任务就是开发以DNA为基础的方法,来精确识别菌株并且克服频繁的噬菌体感染,因为噬菌体感染是困扰乳制品发酵的一大难题。因此,理解特定嗜热链球菌菌株是如何保护自己防止被噬菌体攻击的作用机制既有科学意义,又有商业价值。
2002年下半年,在一次荷兰乳酸菌主题的会议上获知了CRISPR之后,Horvath便开始使用该技术鉴定菌株的基因型。截止到2004年下半年,他注意到间隔与噬菌体抵抗之间存在明确的相关性,在几个月之后Mojica和Vergnaud发表了相同的结果。2005年, Horvath和他的同事们,包括在丹尼斯科美国分公司任职的Rodolphe Barrangou和魁北克城(Quebec City)的拉瓦尔大学(Universite Laval)的杰出的噬菌体生物学家Sylvain Moineau,开始直接验证“CRISPR是一种适应性免疫系统”这一假说。Moineau也曾是一名产业科学家。他在拉瓦尔取得食品科学博士学位,主攻方向就是研究乳酸菌,在回到拉瓦尔工作之前在联合利华公司(Unilever Corporation)工作。自2000年以来,他一直同罗地亚食品公司合作。
利用一种对噬菌体敏感的嗜热链球菌菌株和两种细菌噬菌体,研究人员通过遗传选择来分离抵抗噬菌体的菌株。除了包含传统的抵抗性突变(如噬菌体侵入细胞所需的细胞表面受体上的突变),这种具有抵抗力的菌株在CRISPR基因位点上还获得了噬菌体来源的序列。而且,多重间隔的插入与抵抗力的增强相关,在这种作用下它们获得了免疫功能。
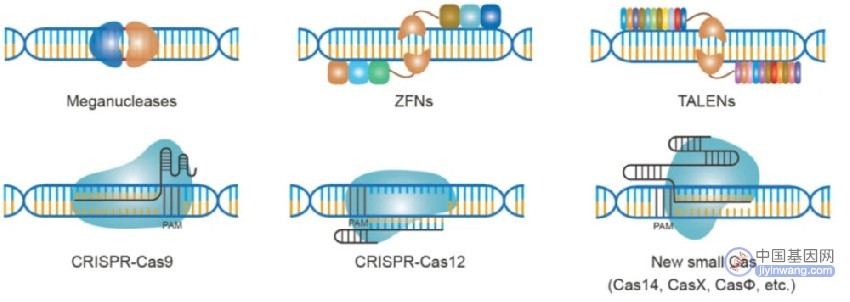
他们也研究了其中的两个cas基因的作用:即cas7和cas9。为了获得抵抗力,细菌需要cas7基因,但是这些携带噬菌体来源的间隔并不需要这个基因来保持抵抗力,这表明cas7参与产生新的间隔和重复,但并不参与免疫本身。相反,包含两种核酸酶模块(HNH和RuvC)的cas9基因对抵抗噬菌体是必不可少的。cas9蛋白是组成细菌免疫系统的活性组分。(提示:在早期的CRISPR文献中,现今著名的cas9基因被称作cas5或者csn1。)
最后,研究人员发现,能够克服基于CRISPR免疫功能的稀有噬菌体分离株在它们的基因里携带单一碱基变化,这种变化改变了与间隔相关的序列。因此,免疫功能的产生依赖于间隔与靶点之间的精准DNA序列的匹配。
为CRISPR编程
1989年,John van der Oost在阿姆斯特丹自由大学(Free University of Amsterdam)获得博士学位,他的理想是通过蓝藻细菌生产生物燃料,解决全球清洁能源的需求。在回到阿姆斯特丹之前,他在赫尔辛基和海德堡工作,研究细菌的代谢途径。1995年,瓦赫宁根大学(Wageningen University)为他提供了一个终身职位,但是有附加条件,即需要他来扩大一个团队,主攻极端条件生存的微生物。在德国期间,他就听说过嗜热链球菌,这种链球菌能够在美国黄石国家公园的温泉中繁殖,他希望能够对这些奇特的微生物在代谢途径上的进化差异进行研究。他开始跟微生物进化和计算机生物学领域的专家Eugene Koonin合作,Eugene Koonin在美国国立卫生研究院(National Institutes of Health,NIH)的国家生物技术信息中心(National Center for Biotechnology Information,NCBI)工作。Koonin已经开始对CRISPR系统进行分类和分析。在2005年的一次访问中,Eugene Koonin将van der Oost带入了这个鲜为人知的CRISPR领域。
Van der Oost已经从荷兰国家科学基金那里获得了主要资助。除了将这笔资助用于解决他计划书中描述的问题之外,他还将部分经费用于CRISPR研究。
Van der Oost和他的同事将一种大肠杆菌的CRISPR系统插入到另一种缺乏自身内源性系统的大肠杆菌中,使得这些大肠杆菌具有由5个cas蛋白组成的复合体,这一复合体被命名为Cascade。
通过分别敲除每个组分,Van der Oost等研究人员证明,在CRISPR基因位点转录的一个长前体RNA接入61个核苷酸长的CRISPR RNA(crRNAs)的过程中,Cascade是必需的。研究人员对crRNAs进行克隆和基因测序发现,crRNAs开始于8个碱基的重复序列,随后完全间隔,然后开始下一次的重复。这些发现支持了早期的假设,即这些重复序列的回文(palindromic)属性将导致crRNA中次级结构的形成。
为了证明crRNA序列是造成基于CRISPR抵抗的原因,研究人员着手创造第一个人工CRISPR序列,以λ噬菌体的四种必不可少的基因作为靶标,对CRISPR进行编程。正如他们预测的一样,携带新的CRISPR序列的细菌株系对噬菌体呈现出抵抗性。这是第一个直接通过编程实现的基于CRISPR的免疫。
这些实验结果也暗示,CRISPR的目标并不是Bolotin所设想的RNA,而是DNA。研究人员设计了两种版本的CRISPR序列,一种是反义链方向的(与mRNA和DNA位点的编码链互补),另一种是正义链方向的(仅仅与另一条DNA链互补)。尽管不同间隔的有效性不太一样,但正义链方向的序列所起的作用有力证明靶标不是mRNA,但并不是直接证据。《科学》杂志的编辑们认为做出明确的结论需要谨慎,所以van der Oost在文章中将“CRISPR以DNA为靶点”作为一种假说提了出来。
DNA是CRISPR的靶点
在从世界著名的噬菌体遗传学家Malcolm Casadaban那里了解到CRISPR时,Luciano Marraffini正在芝加哥大学完成博士学位,研究方向是葡萄球菌(Staphylococcus)。在2005年,Casadaban意识到CRISPR有可能是适应性免疫系统这一发现的重要性,所以他将这一概念告诉给每一个人。像噬菌体协会的许多人一样,Marraffini坚信CRISPR不是通过RNA干扰起作用的,因为这一机制对于克服发生在噬菌体感染过程中的爆发式增长是无效的。事实上,他认为CRISPR必须切断DNA,该功能就好像限制性内切酶的功能一样。
Marraffini殷切希望加入世界上正在研究CRISPR的顶级研究团队,进行博士后研究,但因为他的妻子在库克县的伊利诺伊(Cook County, Illinois)刑事法庭做翻译员,他觉得应该留在芝加哥。他说服Erik Sontheimer让自己加入Sontheimer的实验室,研究CRISPR。Erik Sontheimer是一名从事RNA剪接和RNA干扰工作的西北大学(Northwestern University)的生物化学家。
在搬去西北大学之前,Marraffini在完成博士研究的同时就开始了CRISPR的研究工作,研究葡萄球菌(Staphylococcus)的CRISPR系统是否能够阻止质粒接合。他注意到,一种表皮葡萄球菌(Staphylococcus epidermidis)有一个间隔,与具有抗生素耐药性的金黄色葡萄球菌的质粒上编码切口酶(nickase,nes)基因的某区域相匹配。研究表明,这些质粒不能转化表皮葡萄球菌,但是能中断质粒nes序列或者匹配CRISPR位点的间隔序列,取消干扰。显而易见,CRISPR就像阻止病毒一样阻止了质粒。
Marraffini和Sontheimer想在体外对CRISPR系统进行重组,来证明它可以切割DNA。但是表皮葡萄球菌的系统太复杂,它有9个cas基因,并且基因特征不明确。于是,他们转向了分子生物学。他们修饰质粒中的nes基因,在序列中间插入自我拼接的内含子。如果CRISPR以mRNA为靶点,那么该变化不会影响干扰功能,因为内含子序列会被剪切掉。如果CRISPR以DNA为靶点,那么嵌入部分会取消干扰功能,因为间隔不再匹配。结果很清楚:CRISPR的靶点是DNA。Marraffini和Sontheimer认识到,CRISPR在本质上是一种可编辑的限制性内切酶。他们的论文第一个明确提出预测:CRISPR可以用于在异源性系统内进行基因组编辑。他们甚至提交了包括使用CRISPR在真核细胞内切割或纠正基因位点的专利申请,但是由于缺乏有效性实验,最终放弃了申请。
Cas9是由crRNAs指引并在DNA中产生双链裂断
2007年的一项研究确认了CRISPR是一种适应性免疫系统之后,Sylvain Moineau继续与丹尼斯科公司合作,研究CRISPR切割DNA的机制。但有一个问题,CRISPR在通常情况下非常高效,以至于Moineau和他的同事们无法轻易观察到CRISPR是如何消灭入侵的DNA的。但在研究嗜热链球菌的质粒干扰过程中,他们找到了突破口。研究人员发现,在少数的菌株中,CRISPR对于电穿孔法的质粒转化只具有部分保护作用。在其中一个效率低下的菌株中,研究人员可以看到呈线性的质粒持续存在于细胞中。在一定程度中,质粒干扰的过程被减缓了,以至于可以观察到CRISPR活动的直接产物。
这个菌株可以让他们仔细研究切割的过程。与他们先前的研究结果一致,这次的研究结果显示,质粒的切割依赖于cas9核酸酶。当他们对线性化的质粒进行测序时,他们发现在PAM序列(proto-spacer adjacent motif)上游,有单个精准平端切割的三核苷酸,PAM序列是一种关键性特征序列。他们扩大了分析范围,结果表明,病毒DNA也在与PAM序列有关的相同位置被切割。而且,匹配同一目标的不同间隔数量与观察到的切口数量一致。
研究结果表明,Cas9的核酸酶活性能在精准位点切割DNA,而这些点位则由crRNA的特定序列编码。
tracrRNA的发现
尽管对CRISPR-Cas9系统进行了深入研究,但还是缺失了一部分,即被称为反式作用CRISPR RNA(tracrRNA)的一个小RNA。事实上,它的发现者Emmanuelle Charpentier和Jörg Vogel并不是专门研究CRISPR系统的,他们仅仅试图鉴定微生物RNA。
1995年Charpentier从巴斯德研究所(Pasteur Institute)获得博士学位,之后在纽约做了6年的博士后研究,2002年在奥地利的维也纳大学和2008年在瑞典的于默奥大学(Umeå University)建立了自己的实验室。在化脓性链球菌(Streptococcus pyogenes)里发现了一种不寻常的、可控制其传染力的RNA之后,她开始对鉴定微生物的调控性RNA感兴趣。她用生物信息学的程序检索化脓性链球菌结构的基因间的区域,假设它们可能编码非编码RNA。她发现了一些候选区间,包括CRISPR基因位点附近的一个,但是由于缺乏这些RNA本身的直接信息,研究很难继续。
在2007年召开的RNA学会会议上,Charpentier遇到了Vogel,缺乏RNA本身信息的问题得到了解决。Vogel在德国被培训为微生物学家,在乌普萨拉(Uppsala)和耶路撒冷(Jerusalem)做博士后研究期间他开始重点研究病原体内的RNA。2004年,他在位于柏林的马普感染生物学研究所建立自己的研究小组时也在继续进行这项工作。
随着“下一代测序”技术的发展,Vogel意识到大规模平行测序将会使绘制任何微生物转录组的全部图谱成为可能。他将这种方法用于幽门螺杆菌,同时用于其它细菌。Charpentier和Vogel也决定将目标转向化脓性链球菌。
此方法产生了一个惊人的结果:仅次于核糖体RNA和转运RNA之后数量第三多的RNA转录本属于一种新的小RNA,它是从紧挨着CRISPR基因位点的序列转录过来的,并且有25个与CRISPR重复序列近乎完美互补的碱基。这一互补表明tracrRNA和crRNA的前体杂交,被RNaseIII切割处理成为成熟产物。遗传删除实验证实了这个观点,即tracerRNA对处理crRNA是必不可少的,对CRISPR的功能实现也必不可少。
之后的研究揭示了tracerRNA的另一个关键作用。后续生物化学研究表明,tracerRNA不仅仅涉及处理crRNA,对Cas9核酸酶复合体剪切DNA也是必需的。
目前发现的CRISPR的功能和作用就是这些,至于CRISPR的应用留待下篇讲解。
2013年初,用谷歌搜索“CRISPR”会出现很多的结果,至今仍旧保持这一趋势。研究人员已经报道了在多种生物内使用基于CRISPR的基因组编辑技术,包括酵母、线虫、果蝇、斑马鱼、小鼠和猴子。研究人员更感兴趣的是在人类医疗和农业生产的潜在应用的科学和商业价值,同时这个技术可能被用来培育设计婴儿的前景也引发了社会关注。
以遗传性疾病为例,最近该技术已经用于杜氏肌营养不良(Duchenne’s muscular dystrophy,DMD)的小鼠模型。三组研究人员近期已经描述了CRISPR-Cas9技术用于移除编码DMD蛋白的基因突变,由此影响该蛋白的表达、治疗DMD。
研究人员利用CRISPR-Cas9基因编辑系统,剪切了小鼠模型的DMD突变部分,从而可以允许肌纤维中的抗萎缩蛋白的较短部分得到合成,恢复了部分肌肉功能。这种方法可以移除大概80%DMD患者的基因突变。
研究人员利用基因治疗载体——腺相关病毒载体(adeno-associated virus,AAV)传递必需的CRISPR-Cas9成分到肌肉中,对小鼠的肌肉来说这是一种有效的基因传递载体,但是这种载体限制携带DNA的容量,比如DNA的长度要小于4.7kb。编码Cas9核酸内切酶的基因被包裹在一个AAV载体中;Cas9蛋白,一种核酸内切酶,剪切DNA。引导RNA(guide RNA,gRNA)序列被包裹在一个不同的AAV颗粒中,该gRNA能指导CRISPR-Cas9蛋白到特定的DNA序列。一旦gRNA连接到它的同源DNA序列,Cas9核酸内切酶就会顺着DNA进行切除。
AAV载体被传递进入杜氏肌营养不良模型鼠mdx中,该小鼠模型在 Dmd基因的第 23外显子位置携带无义突变。该变异导致Dmd 信使RNA(messenger RNA,mRNA)翻译成蛋白的过程过早的终止,由此终结了抗肌萎缩蛋白的产生。在 CRISPR-Cas9 基因校正策略中,gRNAs引导Cas9蛋白切割两个非编码内含子,它们位于外显子23的两边。切割的末端被细胞的内源性非同源末端连接功能重新连接上,允许Dmd基因 mRNA的阅读框保持完整。尽管没有被切除外显子编码的氨基酸,但是依旧可以生成抗肌萎缩蛋白。
基因校正的初始有效率预估约为2%。但抗肌萎缩蛋白的水平一直在增加,也许是因为不断的校正,从肌纤维的AAV构建,这个过程可以持续数月。一组研究人员提出的证据表明,基因校正也发生在卫星细胞、肌肉的干细胞。采用AAV或电穿孔法(electroporation)引导 CRISPR-Cas9 和 gRNAs(设计为切除DMD的21和23外显子)至 mdx 小鼠肌肉中的类似研究也提供了证据,证明肌肉功能获得了改善。但是,这些基因传递的方法很难转化到临床,进行实际应用。
CRISPR-Cas9方法同其他正在发展的方法相比究竟如何呢?通过对基因组进行改变,可以获得对肌细胞的永久性修复。与目前正在进行临床试验评估的“外显子跳跃”寡核苷酸的药物相比较:这些寡核苷酸被强制进行选择性剪接,DMD外显子含有的突变拼接出mRNA ,导致截短的抗肌萎缩蛋白合成。但是因为外显子跳跃的试验药物没有改变根本的DMD序列,所以不得不频繁重复给药。另一种方法是AAV基因治疗方法:它涉及用截短的“微缩”版DMD。较短的DNA序列装配到AAV载体中,被认为在小鼠上是有效的,虽然合成全链蛋白更为理想。这种策略不需要控制宿主细胞基因组,每一个接受AAV-微抗肌萎缩蛋白载体的肌细胞都会产生治疗性蛋白;此外,该策略是通性的,并不需要对每个患者进行量身定制。然而,通过AAV载体实现的表达预期是不会长久的,所以抗肌萎缩蛋白的产生可能不会像在CRISPR校正肌细胞中那样长时间存在。另外,“微缩”DMD编码抗肌萎缩蛋白比由CRISPR-Cas9修饰的 DMD 要小,所以在功能上有所打折。
阻碍 CRISPR-Cas9技术应用的因素包括有效率相对低下。Dmd 表达仅在一部分经过治疗的细胞中才有。尽管CRISPR-Cas9 系统的精确度不断在改善,但是对于那些不希望被切割的基因组位置仍然存在脱靶的风险。因此,在证明 CRISPR 系统能足够安全地进行临床试验之前,还需要进行更多的研究工作。同时也存在一个普遍的问题,就是如何能将CRISPR-Cas9有效传递至DMD患者大量受累的肌肉中。在小鼠模型试验中AAV 载体的表现非常好,但是是否在人体组织中也能进行准确无误的传递还是一个未知数。而且载体需求量很大,生产如此大量的载体很困难,且费用高昂。此外,人体对AAV衣壳、Cas9蛋白和抗肌萎缩蛋白的免疫反应就是一个潜在的障碍。对于这些问题都可以找到解决方法,正如存在可以避免这些问题的方法一样。能治疗如 DMD 这类疾病的方法将会越来越多,终会有一种方法获得成功。
对于很多遗传性疾病而言,CRISPR技术就是未来的曙光和希望。不论未来的路有多艰难,研究人员都会一如既往地前行。每一项技术应用到临床都需要经过重重验证。为了造福人类,CRISPR技术英雄榜上的每一个研究人员都付出了努力和汗水,相信在不久的将来CRISPR英雄将看到该技术成功应用于临床的一天。
CRISPR的启迪
CRISPR的早期开拓者在研究道路上继续前行,但是开拓者已经不再孤单,全世界有更多的研究人员进入这一领域,成为新的CRISPR英雄,他们进一步地阐明CRISPR的生物学,改善和扩展基因组编辑技术,并且用于解决更多的生物学问题。20年前在西班牙盐沼泽发现的曾经不为人知的微生物学系统如今却成了各大科学期刊、纽约时代杂志的头条、学术会议的焦点。CRISPR的时代已经来临。
CRISPR的故事引起了研究人员对人类生态系统的思考,人类生态系统可以促进科学进步,而这些进步与基金组织、普通公众和充满热情的研究人员密不可分。
最重要的一点就是医学突破经常出现在意想不到的地方。CRISPR早期英雄们的研究方向都不是研究编辑人类基因组,甚至都不是研究人类疾病。他们的研究初衷混合了个人兴趣(为了弄清楚耐盐细菌奇怪的重复序列)、军事上的迫切需求(为了防范生物战争)和在工业上的应用(为了提高酸奶产量)。
这段历史也说明了基于大数据的“无假设”发现在生物学中越来越重要。CRISPR基因位点、生物学功能和tracrRNA的发现都不是来自实验台上的实验,而是来自大范围、公开的基因数据库的生物信息学的开放式探索。“假设驱动”科学依然是基本的研究过程,但是21世纪将会看到更多将两种研究方法相结合而发现的新事物。
许多CRISPR英雄们在他们30岁之前科学生涯的起点就开始了他们的重要工作,比如Mojica,Marraffini,Charpentier,Vogel等。因为年轻喜欢冒险,经常在无人涉足的方向和看似无人问津的问题上冒险,并且渴望获得成功,成为他们的动力。对于如今这个首次获得NIH资助的平均年龄已经升到42岁的时代而言,这是一个重要的提醒。
还需要注意一点,很多人取得标志性的工作结果并不是在常规的科学研究地点,而是在一些非科学研究地方,如西班牙的阿利坎特;法国的国防部;丹尼斯科的公司实验室。而且,他们的重要论文都被一流杂志拒绝过,在延迟很久之后才得以发表,并且不受关注。这些遭遇并非巧合:这些研究地点可能给了非热门研究更大自由,但是对于如何克服期刊和评审人的怀疑,这方面的支持却是很少的。
这段发展史充满了传奇色彩,只要你有一双善于发现的眼睛,哪怕提出的问题无法获得确切的答案,但只要结果真实存在,经过不懈的努力,总会获得成功。对于普通公众和充满热忱的年轻研究人员,这是精彩的一课,也给未来的研究人员带来深刻启迪。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。