里程碑!全球首个现货型异体T细胞免疫疗法在欧盟获批!
今日,Atara Biotherapeutics和Pierre Fabre联合宣布,欧盟委员会(EC)批准其免疫疗法Ebvallo(tabelecleucel)上市,作为单药治疗EB病毒(EBV)相关的移植后淋巴增殖性疾病(EBV+PTLD),病患包含曾至少接受过一次前期治疗的成人与2岁以上儿童患者。此款疗法于今年10月获得欧盟人用药品委员会(CHMP)上市许可推荐。根据新闻稿,这是全球首项获批的同种异体T细胞免疫疗法。

EBV+PTLD是淋巴瘤的一种类型,是一种罕见、急性可能致死的血液癌症,可能在实体器官移植(SOT)或同种异体造血细胞移植(HCT)后发生。一线治疗失败的HCT后EBV+PTLD患者的中位总生存期为16-56天,而SOT后高危EBV+PTLD患者的1年和2年生存率分别为36%和0%。这些患者具有显著的未竟医疗需求。
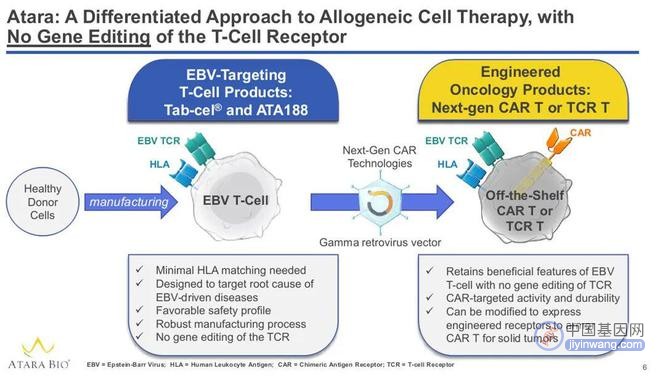
▲靶向EBV现货型T细胞疗法原理(图片来源:参考资料[2])
Ebvallo是一款现货型同种异体T细胞免疫疗法,以人类白细胞抗原(HLA)限定的方式靶向受EBV感染的细胞。该疗法除了针对利妥昔单抗治疗失败的移植后EBV+PTLD患者,还计划用于治疗包括鼻咽癌在内的其他EBV相关血液癌症和实体瘤。2015年2月,美国FDA授予Ebvallo用于治疗HCT后产生EBV+PTLD的突破性疗法认定(BTD)。此疗法亦获得欧盟孤儿药资格与PRIME资格。
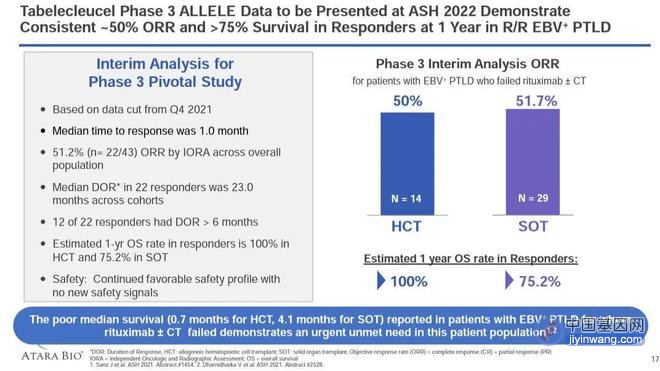
▲靶向EBV现货型T细胞疗法3期试验结果(图片来源:参考资料[2])
Ebvallo的上市申请是基于一项3期临床试验所获得的积极数据,去年底所公布的数据显示,截至2021年5月,在38例可评估患者(24例SOT后,14例HCT后)中观察到的平均客观缓解率(ORR)为50%(19/38,95% CI:33.4,66.6),包括完全缓解(CR;n=5,SOT;n=5,HCT)和部分缓解(PR;n=7,SOT;n=2,HCT)。在19例获得缓解的患者中,11例患者的缓解持续时间(DOR)超过6个月,中位缓解持续时间尚未达到。安全性方面与之前发表的数据一致,未报告新的信号或问题。未发生移植物抗宿主病(GvHD)、器官排斥、输注反应或与Ebvallo相关的细胞因子释放综合征等不良反应。
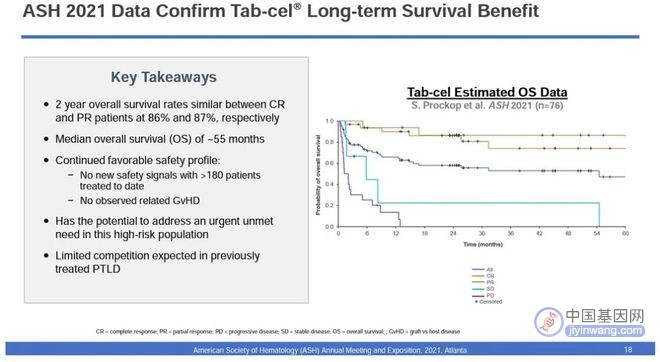
▲靶向EBV现货型T细胞疗法长期生存期数据(图片来源:参考资料[2])
“Ebvallo在欧盟的获批对于那些具显著未竟医疗需求的患者而言是一项医疗上的突破,”Atara的总裁兼首席执行官Pascal Touchon博士说道,“这是获全球监管单位首次批准的同种异体,即源于捐赠者的T细胞免疫疗法,这对Atara、我们在欧洲的合作伙伴Pierre Fabre,甚至是整个细胞疗法领域而言是个历史性的时刻。”
参考资料:
[1] Atara Biotherapeutics’ Ebvallo™ (tabelecleucel) Receives European Commission Approval as First Ever Therapy for Adults and Children with EBV+ PTLD. Retrieved December 19, 2022 from https://investors.atarabio.com/news-events/press-releases/detail/301/atara-biotherapeutics-ebvallo-tabelecleucel
[2] Investor Presentation. Retrieved December 19, 2022 from https://d1io3yog0oux5.cloudfront.net/_44efd905b875b17acdc86dab1622cece/atarabio/db/640/5542/pdf/ATRA+Investor+Presentation+Nov+8+2022_Final.pdf
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。