复旦团队通过基因编辑筛选发现三阴性乳腺癌新靶点

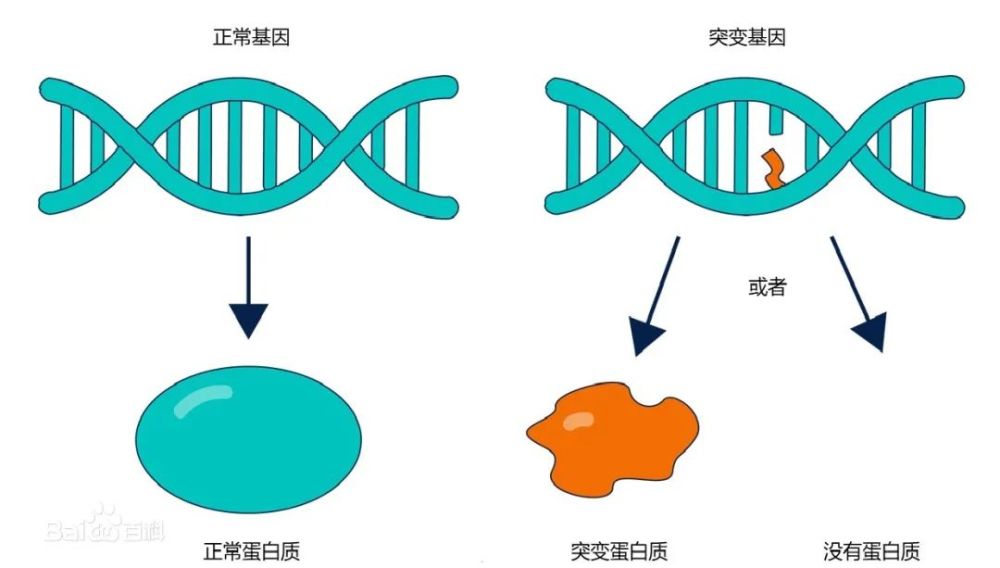
三阴性乳腺癌与雌激素受体、孕激素受体或HER2阳性乳腺癌相比,内分泌治疗或HER2靶向治疗效果较差,侵袭性较强、进展较快、复发转移风险较高,目前针对三阴性乳腺癌的有效治疗手段十分有限,因此探究三阴性乳腺癌的发展机制,进而挖掘潜在有效治疗靶点已成为乳腺癌领域亟待解决的问题。核糖核酸(RNA)携带着基因转录翻译为蛋白质制造机制的遗传密码。如果说基因是银行卡,那么RNA就是读卡器、蛋白质就是钞票。基因→RNA→蛋白质任何一环失调,都容易引起癌症的发生和发展。RNA结合蛋白是结合RNA并参与形成核糖核蛋白复合物的蛋白质,RNA结合蛋白失调也是癌症的特征之一,研究RNA结合蛋白异常的生物学功能和分子学机制,有助于发现新的三阴性乳腺癌生物标志物和治疗策略。
2023年6月2日,美国癌症研究协会《癌症研究》清样发表复旦大学附属肿瘤医院卢训西①、杨闻箫①、裴雨晨、骆红、李小光、王云锦、张国亮、凌泓、邵志敏、胡欣✉团队的研究报告,发现了细胞核小核糖核蛋白多肽C(SNRPC)调控三阴性乳腺癌进展的新机制。该研究由国家科学技术部、国家自然科学基金委员会和上海市科学技术委员会资助。
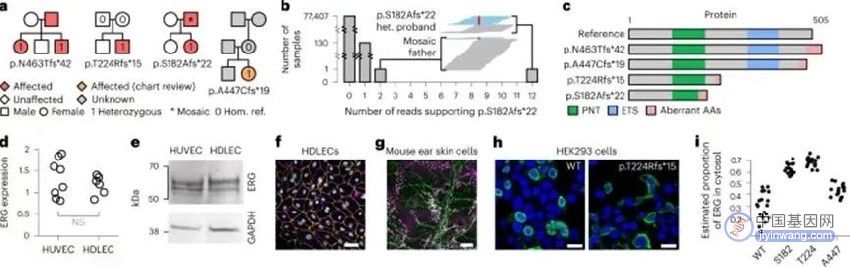
为了确定三阴性乳腺癌的致癌RNA结合蛋白,该研究首先利用体内基因编辑技术对三阴性乳腺癌进展模型进行RNA结合蛋白功能筛选,发现其中SNRPC是三阴性乳腺癌发展的关键因子,并充分证实SNRPC可影响三阴性乳腺癌细胞的增殖、迁移以及侵袭等重要生物学功能。
该研究随后发现SNRPC作为U1细胞核小核糖核蛋白颗粒的特殊亚基,不仅通过自身锌指蛋白质结构参与维持核糖核蛋白复合物的稳定性,更重要的功能是介导U1细胞核小核糖核蛋白颗粒与RNA聚合酶II的非RNA依赖性结合,对RNA聚合酶II的转录活性进行调节,激活下游多个癌基因TNFAIP2、E2F2和CDK4的转录。
此外,SNRPC水平上调常见于生存结局显著较差的三阴性乳腺癌患者。无论在体外还是在体内,清除SNRPC可显著减少三阴性乳腺癌细胞的增殖、迁移和侵袭。抑制SNRPC表达可降低TNFAIP2、E2F2和CDK4等癌基因RNA聚合酶II富集并降低其表达水平。SNRPC缺失还被证实可通过调节TNFAIP2 → Rac1 → β联蛋白信号传导通路部分抑制三阴性乳腺癌进展。
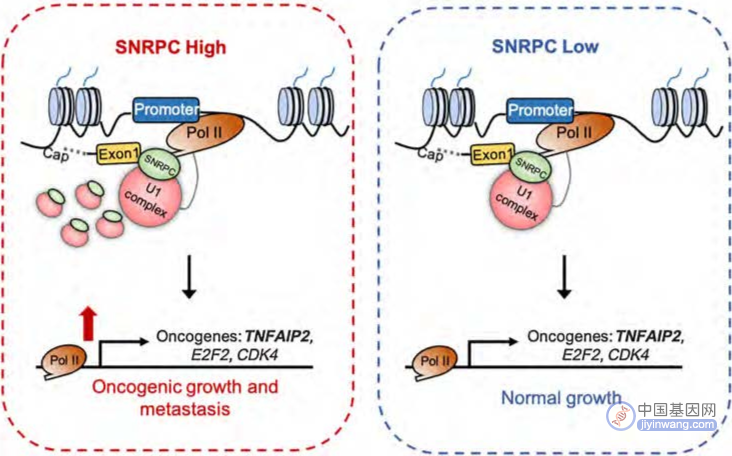
因此,该研究结果首次揭示SNRPC调控三阴性乳腺癌进展的复杂机制,并提示SNRPC可能是难治型三阴性乳腺癌患者有价值的预后标志物和治疗新靶点,故有必要进一步开展临床研究进行验证。
复旦大学附属肿瘤医院胡欣研究团队一直致力于完善RNA结合蛋白调控三阴性乳腺癌进展的理论机制:2018年,揭示了U2细胞核小核糖核蛋白颗粒亚基PHF5A通过识别H3K4me3信号调控三阴性乳腺癌恶性进展,发表于美国癌症研究协会《癌症研究》;2020年,延续工作揭示了CPSF1基因调节RNA聚合酶A加尾信号对三阴性乳腺癌的发展非常重要,发表于常春藤旗下《治疗诊断学》;2023年,本工作揭示U1细胞核小核糖核蛋白颗粒亚基SNRPC调控三阴性乳腺癌进展的新机制,SNRPC通过依赖RNA聚合酶II的途径调控RNA转录,促进了多个癌基因的激活。系列工作丰富了三阴性乳腺癌RNA结合蛋白失调与肿瘤相关RNA之间复杂的相互作用网络,完善了三阴性乳腺癌调控的理论体系。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。