Nature子刊:胡家志/杨辉团队使用Cas9TX实现安全高效的体内基因编辑

CRISPR-Cas9是目前领域内最为常用的基因编辑工具,在基础科研领域以及临床应用上都有着广阔的使用前景。然而Cas9在完成靶向位点突变的同时,还会在脱靶位点进行切割,并会造成染色体易位和染色体大片段缺失等染色体结构异常副产物。
除此之外,在以腺相关病毒(AAV)为递送载体的体内基因编辑治疗中,存在着AAV片段高频插入的现象。这些基因编辑中的副产物严重威胁了基因组的稳定性,可能会导致细胞的癌化,为基因编辑的治疗结果带来不确定性。通过抑制Cas9反复切割靶向位点的完美修复产物,胡家志课题组近期发表的可以在CAR-T的改造过程中大幅度降低染色体易位的发生频率,但在与临床应用更为密切相关的体内基因编辑场景中,Cas9TX能否有效降低这些副产物的产生仍需要进一步印证。
近日,北京大学胡家志团队与中科院神经所杨辉团队合作,在 Nature 子刊 Nature Communications 发表了题为:Safeguarding genome integrity during gene-editing therapy in a mouse model of age-related macular degeneration 的研究论文。
该研究在年龄相关性黄斑病变(AMD)的体内基因编辑治疗模型中,首次定量揭示了CRISPR-Cas9在体内基因编辑过程中染色体易位和腺相关病毒(AAV)片段插入的发生模式与发生频率,并使用胡家志课题组之前开发的Cas9TX变体大幅度减少了这些副产物在体内基因编辑过程中的产生,为CRISPR-Cas9的临床应用提供了重要的指导意义。

年龄性黄斑病变是世界范围内导致老年人失明的主要原因之一。其中湿性黄斑病变主要是视网膜后的异常血管增生所导致的。目前以注射拮抗调控血管生成的VEGFA蛋白的小分子或抗体为治疗该疾病的主流手段,但反复注射不但不能保证治疗效率也会对眼部造成局部并发症。近期以CRISPR-Cas9为主的基因编辑技术为治疗该疾病带来了曙光,通过激光照射小鼠眼部造成新生血管入侵视网膜来模拟黄斑病变,研究者们进一步通过Cas9靶向Vegfa,从而一劳永逸地消除新生血管的产生,为治疗该疾病提供了临床的可操作性。
利用胡家志课题组开发的全面评估基因编辑工具安全性的高通量测序方法PEM-seq,该工作首先在以双AAV载体包装系统为递送载体的小鼠眼部脉络膜增生编辑模型中(靶向Vegfa位点),发现了体内基因编辑过程中靶向位点和脱靶位点之间,靶向位点和基因组自发产生的DNA双链断裂之间仍然会形成染色体易位(频率接近1%)(图a)。与此同时,该研究也发现靶向位点上存在着频率高至40%的AAV片段整合(图b)。更为重要的是,这些副产物在基因编辑后可以在体内稳定存在12周之久,引发了研究者对于这些副产物的担忧。
随后该工作利用双AAV载体递送Cas9TX靶向小鼠眼部的Vegfa,结果表明Cas9TX不仅能够提高靶向位点的编辑效率,完成对小鼠脉络膜增生模型的治疗,而且还能大幅度消除靶向位点上所产生的染色体易位(图c),值得一提的是Cas9TX并没有在脱靶位点造成更高的编辑效率。更为重要的是,该工作发现了Cas9TX也可以有效降低AAV片段在靶向位点的整合(图d),据悉这是领域内首个可以减少AAV片段在基因编辑过程中插入的基因编辑工具,对临床上的应用具有重要的意义。
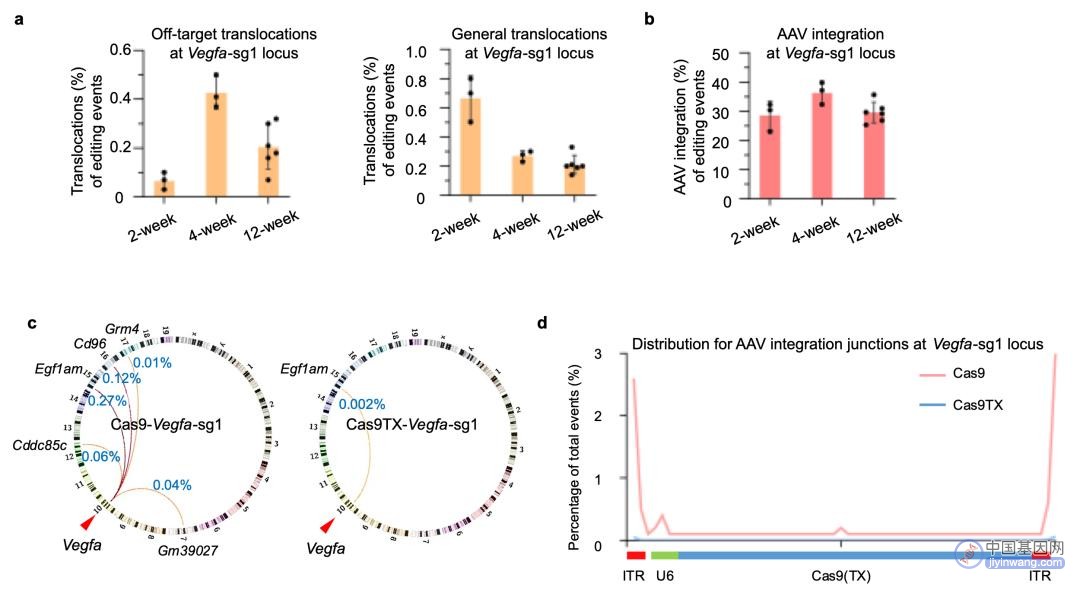
图:a. PEM-seq检测在小鼠眼部Vegfa位点Cas9编辑后染色体易位的发生频率。b. PEM-seq检测在小鼠眼部Vegfa位点Cas9编辑后AAV片段插入的频率。c. Cas9TX大幅度降低染色体易位产生的比例。d. Cas9TX大幅度降低AAV片段插入的比例。
总体而言,该研究不仅表明了Cas9TX可以成功兼容双AAV递送系统用于体内基因编辑,大幅低降低基因编辑过程中的副产物,也说明了DNA损伤修复在体外与体内的相对保守性,以此为出发点进行基因编辑安全性优化的可行性。
北京大学、北大-清华生命科学联合中心胡家志研究员和中科院神经所杨辉研究员为该论文的共同通讯作者。上海复旦大学附属眼耳鼻喉科医院干眼中心主任洪佳旭医生也该论文做出了指导。北京大学前沿交叉学院2022届博士研究生尹健行,上海中科院神经所博士后方凯伦,博士后高艳霞为该文章的共同第一作者。北京大学生命科学学院本科生元绍鹏,博士研究生欧丽琼,辛昌昌以及上海辉大公司高级经理吴炜炜与吴伟威研究员对此工作亦有重要贡献。
论文链接:
https://www.nature.com/articles/s41467-022-35640-4
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。