逆转衰老新赛道!中国科学家发现人类“年轻化”基因,有助于干预器官退行
随着人口老龄化的到来,衰老相关疾病的高发正成为全球共同面临的健康挑战。延缓衰老,增强衰老组织活力和功能维持,进而促进老年健康是亟待解决的世界性科学难题。细胞衰老(cellular senescence)指的是一种“僵而不死”的静止状态。随着年龄增长,机体内滞留的衰老细胞影响了正常的组织器官功能,是众多衰老相关疾病发生的关键原因。如何延缓甚至逆转细胞衰老,已成为生命科学领域最前沿的科学问题之一。
细胞更生(cellular rejuvenation)是指通过干预手段实现衰老细胞年轻化、重现细胞活力的过程。通过重塑表观遗传和基因表达程序使细胞“返老还童”,是延缓衰老、防治衰老相关疾病的重要方法和策略之一。刘光慧研究员及合作者在国际上率先利用体细胞重编程(somatic reprogramming)技术,向人类儿童早衰症成纤维细胞中导入了由日本科学家山中伸弥发现的4个重编程因子OSKM(Oct4, Sox2, Klf4, c-Myc),实现了衰老细胞表观基因组重塑,逆转了人类细胞的衰老时钟(Nature 2011)。该研究衍生了后续一系列通过部分重编程(partial reprogramming)技术进行衰老干预的探索,并在啮齿类动物模型中取得了成功(Cell 2016,Nature 2020等)。
目前,部分重编程技术已经成为实现器官和细胞更生的重要路径,病毒载体介导的重编程因子“疗法”在模式动物中显示出延缓器官退变的潜力。然而,异源表达这些重编程因子的细胞更生方案不可避免地存在擦除成体细胞分化状态、改变初始“细胞身份”(cell identity)、诱发肿瘤等风险。这些在一定程度上限制了重编程技术在衰老干预中的临床应用前景。因此,领域内亟需发现独立于重编程因子的全新细胞更生因子,并据此发展更为安全、高效的衰老干预策略。
2023年10月12日,中国科学院动物研究所刘光慧课题组、曲静课题组和中国科学院北京基因组研究所张维绮课题组、任捷课题组合作在《细胞-干细胞》(Cell Stem Cell)在线发表研究论文,鉴定出一系列促更生因子(rejuvenation factor),其中转录因子SOX5为筛选名单中全新、强效的更生因子。基于SOX5过表达的“基因疗法”可以延缓小鼠关节衰老,促进关节软骨再生并改善骨关节炎症状。这为人类衰老相关疾病的防治提供了新的研究方向。

研究人员基于团队前期建立的人间充质前体细胞衰老研究体系,利用CRISPR激活(CRISPR activation, CRISPRa)工具介导的基因功能增强(Gain-of-function)筛选技术,对全基因组范围内的两万多个蛋白编码基因进行了全面排查,首次系统鉴定人间充质前体细胞的更生因子合集。
据论文作者介绍,这项筛选技术具有多项优势:“首先,CRISPRa全基因组sgRNA文库覆盖全基因组范围内的蛋白编码基因,甚至同一基因的同源异构体,具有较强的系统性,且减少了筛选工作量;其次,通过转录激活因子结合在转录起始位点提高基因的表达水平,不受转录本大小限制,且避免了过量表达ORF/CDS可能对细胞产生的毒副作用;再者,多条sgRNA靶向一个基因,能有效降低假性筛选结果;最后,一些蛋白的ORF/CDS太大,用传统转染或感染方法无法导入到细胞中,表达效率极低,而sgRNA可以均一导入到每一个细胞中。”
通过对排名前列的强效更生因子开展独立功能分析,研究人员证实了这些因子的激活均可延缓人间充质前体细胞衰老,提示这个更生因子合集是一个值得挖掘的基因资源库。其中,转录因子SOX5与重编程因子SOX2属同一蛋白家族,且表现出显著的促细胞年轻化能力,因而成为研究团队关注的焦点。
接下来,研究团队通过多种技术手段、结合多种生理与病理性人类细胞衰老模型,证实SOX5可在不改变细胞身份的前提下促进人类细胞更生。为进一步探究更生背后的分子机制,研究人员通过表观和转录组学技术联合分析SOX5的作用靶点,发现SOX5可作为转录激活因子结合于衰老抑制基因HMGB2增强子区域,从而激活HMGB2的表达,启动了细胞年轻化进程。与之相对,抑制SOX5或HMGB2表达会加速细胞衰老。由此,研究团队揭示了SOX5-HMGB2轴有助于激活年轻化的染色质状态,降低DNA损伤水平,或可作为干预人类细胞衰老的关键靶标。
随后,研究人员通过在老年小鼠关节给予SOX5基因治疗验证其潜在应用价值。结果显示SOX5基因治疗可有效延缓关节细胞衰老,抑制骨赘和滑膜增生,降低关节腔炎症水平并促进软骨再生。行为学实验进一步支持了上述结果,治疗组动物的肢体抓力显著提升。进一步,研究团队平行比较了SOX5基因治疗和重编程因子OSKM基因治疗在延缓骨关节炎方面的效果。两种处理在多项关节衰老的评价指标上效果相当,但由于SOX5单因子治疗不会引起细胞身份的改变,且SOX5单因子核酸编码序列较短,更容易在细胞中均衡表达,因而SOX5基因治疗在长期干预效果上可能具有更好的安全性和有效性。综上,基于SOX5的基因疗法或有望实现器官衰老的干预,助力延长健康寿命。
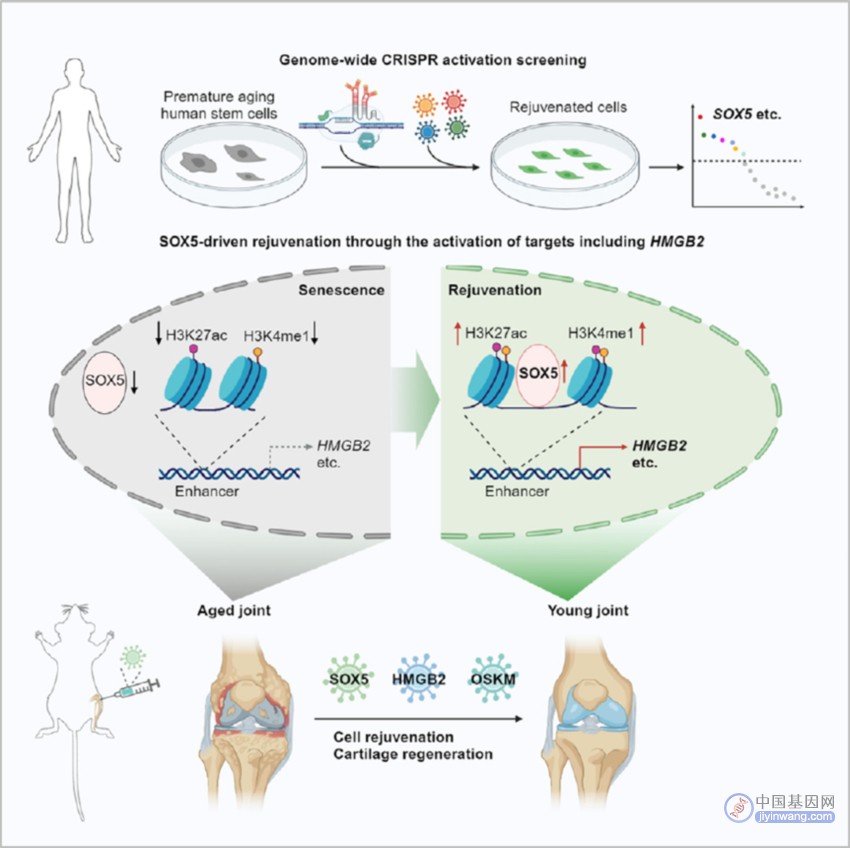
▲研究示意图(图片来源:原始论文)
对于接下来的研究,论文作者表示,研究团队将探索SOX5基因治疗对不同组织衰老,以及机体寿命和健康寿命的影响;此外,他们还将研究鉴定出的其他促更生因子能否像SOX5一样延缓组织和器官的衰老。
该研究是合作团队于2021年明确人类全基因组衰老促进基因名录(Science Translational Medicine 2021)之后,针对人类基因组中衰老抑制基因,首次系统筛选出SOX5等新型促更生因子。该研究加深了科学界对衰老程序化理论的认识,揭示了独立于重编程因子的全新细胞更生因子合集,并发展了逆转细胞和组织衰老的新型策略。这些新的知识和技术体系为阐明驱动衰老的分子通路、建立人类器官衰老及相关退行性疾病的临床诊断及干预手段提供了新的可能。
该研究由中国科学院动物研究所、中国科学院北京基因组研究所、北京干细胞与再生医学研究院、首都医科大学宣武医院等多家机构合作完成。中国科学院动物研究所博士研究生荆耀彬和蒋晓钰为文章的并列第一作者。中国科学院动物研究所刘光慧研究员、曲静研究员及中国科学院北京基因组研究所张维绮研究员和任捷研究员为文章的共同通讯作者。研究获得科技部、国家自然科学基金委、中国科学院和北京市等项目资助。
原始论文:
Jing et al., Genome-wide CRISPR activation screening in senescent cells reveals SOX5 as a driver and therapeutic target of rejuvenation. Cell stem cell (2023). DOI: 10.1016/j.stem.2023.09.007
参考资料:
[1] Recapitulation of premature ageing with iPSCs from Hutchinson-Gilford progeria syndrome. Nature. 2011 Apr 14;472(7342):221-5. doi: 10.1038/nature09879
[2] In Vivo Amelioration of Age-Associated Hallmarks by Partial Reprogramming. Cell. 2016 Dec 15;167(7):1719-1733.e12. doi: 10.1016/j.cell.2016.11.052
[3] Reprogramming to recover youthful epigenetic information and restore vision. Nature. 2020 Dec;588(7836):124-129. doi: 10.1038/s41586-020-2975-4
[4] A genome-wide CRISPR-based screen identifies KAT7 as a driver of cellular senescence. Sci Transl Med. 2021 Jan 6;13(575):eabd2655. doi: 10.1126/scitranslmed.abd2655
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。