Cell重磅:Cas9会导致染色体丢失,诺奖团队开发改进方案,提高基因编辑的临床安全性

CRISPR-Cas9基因编辑技术的出现显著改变了基因编辑领域的格局,为科学家自由操纵基因提供了前所未有的简便和高效。但CRISPR基因编辑的精确性对于确保临床安全性和避免意外、永久性的基因毒性至关重要。
近年来,CRISPR-Cas9基因编辑使先进的T细胞疗法成为可能。虽然Cas9在体外和体内的脱靶编辑已经得到了广泛的研究和缓解,但靶向基因组编辑后意料之外的染色体异常,例如染色体缺失,尚未被系统地调查或预防。这些隐患使得临床上对于CRISPR-Cas9基因编辑的潜在担忧继续存在。
2023年10月3日,诺贝尔化学奖得主、加州大学伯克利分校的 Jennifer Doudna 教授,联合加州大学旧金山分校的 Chun Jimmie Ye、斯坦福大学的张元豪、宾夕法尼亚大学的 Carl June 等人,在 Cell 期刊发表了题为:Mitigation of chromosome loss in clinical CRISPR-Cas9-engineered T cells 的研究论文。
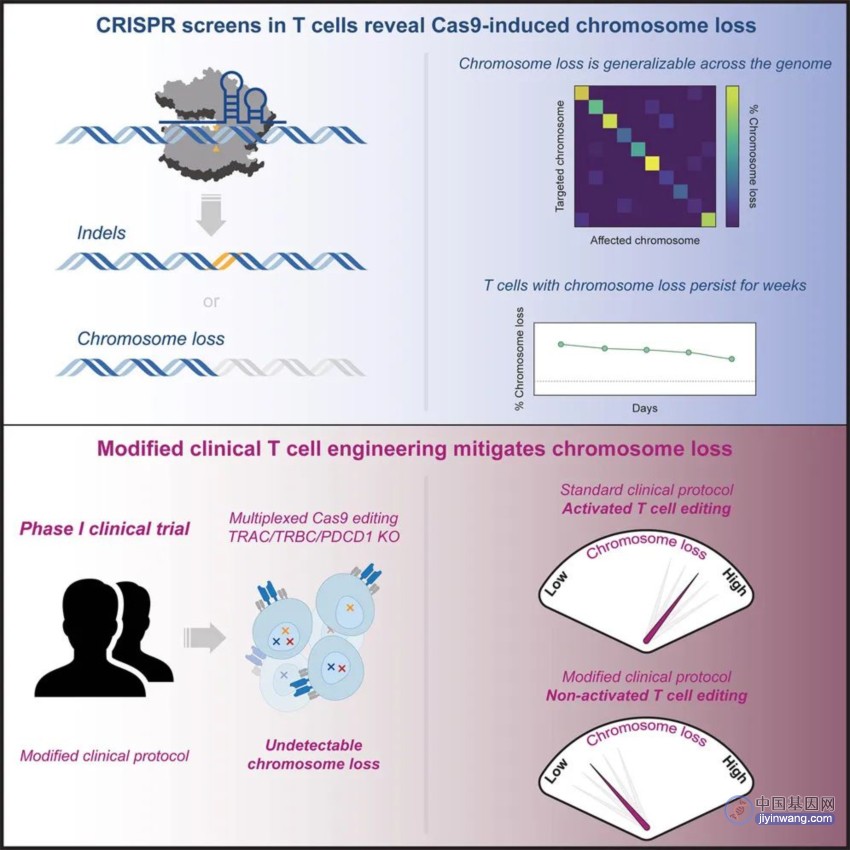
该研究表明,CRISPR-Cas9基因编辑诱导的染色体缺失是一种普遍现象,由此产生的缺陷型T细胞在适应性和增殖上具有劣势,但仍可以在体外培养中持续存在数周,这可能对临床应用产生不良干扰。此外,研究团队提出了一种新的T细胞基因编辑方案,可以减少基因编辑中染色体缺失的发生,提高临床安全性。

当前,T细胞疗法蓬勃发展,该技术利用Cas9对T细胞进行了广泛的工程改造,以开发针对癌症和自身免疫性疾病的有效免疫疗法。但令人担忧的是,此前有研究显示,Cas9编辑导致原代人T细胞的染色体的非整倍性(aneuploidy)。
然而,染色体缺失在其他靶点发生的程度、这种现象的决定因素、Cas9诱导染色体缺失的T细胞行为以及这些发现的临床相关性仍然未知。随着对这一现象的理解,减少或消除作为基因组编辑结果的染色体缺失的策略将提高工程T细胞疗法对患者的安全性。
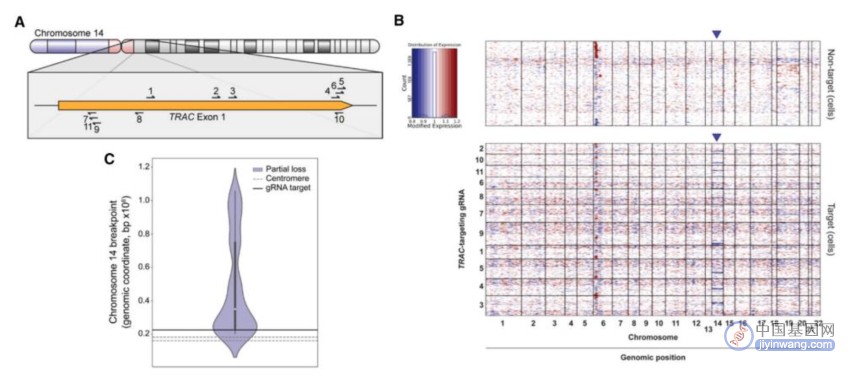
CRISPR-Cas9基因组编辑导致靶染色体的部分和全部缺失
在这项最新研究中,为了探究CRISPR-Cas9诱导的染色体缺失是否是一种普遍现象并评价其临床意义,研究团队对人原代T细胞进行了系统分析。他们分析了人类基因组中每个体细胞染色体上数百个位点的Cas9诱导的基因组编辑后的染色体缺失,以确定这种现象的频率、决定因素和后果。
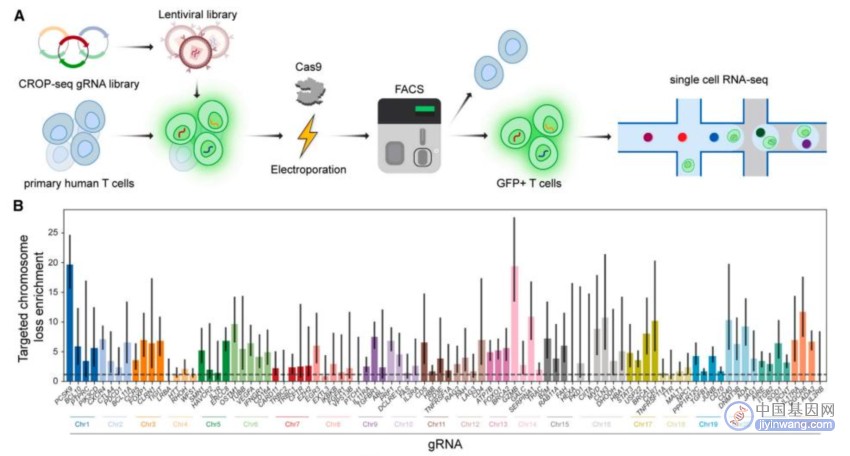
基因组规模的CRISPR-Cas9筛选显示了靶标特异性的染色体缺失
通过单细胞RNA测序(scRNA-seq)和微滴数字PCR(ddPCR),研究团队发现,Cas9诱导的染色体缺失是一种普遍现象,发生在整个基因组的目标位点,特定于Cas9靶向的染色体。此外,虽然Cas9诱导的染色体缺失的T细胞具有适应性和增殖劣势,但可以进行持续数周的离体培养,这意味着它们可能会干扰临床应用。
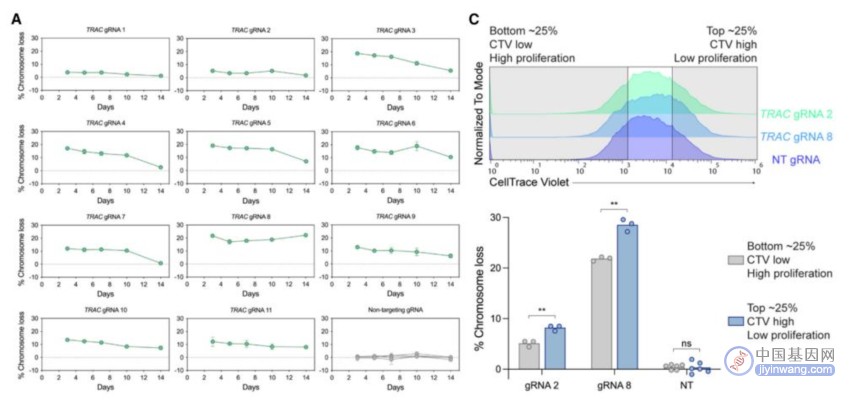
Cas9诱导的染色体缺失的T细胞的适应性和增殖能力降低,但仍可以持续存在数周
令人惊讶的是,Cas9介导的染色体缺失也发生在CAR-T细胞的临床前生产过程中,但在首次人体1期临床试验中经过Cas9基因编辑的患者T细胞中很少或检测不到。
接下来,研究团队在CRISPR-Cas9工程T细胞的首次人体临床试验(NCT03399448)中采用了一种新的T细胞基因编辑方案,不仅减少了染色体缺失,同时还在很大程度上保留了基因组编辑的功效。
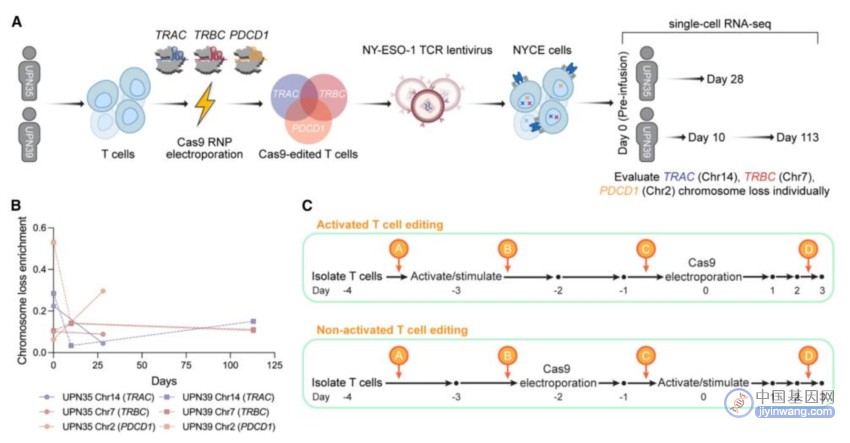
新的T细胞编辑方案减轻患者T细胞的染色体缺失
研究团队表示,这种改良方案增加了DNA损伤反应蛋白p53的水平,从而保护染色体并避免其缺失。这表明Cas9诱导的染色体缺失很可能是通过产生DNA双链断裂(DSB)进而诱导同源定向修复(HDR)所致。因此,不产生DNA双链断裂(DSB)的CRISPR基因编辑技术,例如碱基编辑或表观基因编辑,可能会避免高水平的染色体缺失。
研究模式图
总而言之,这项发表于 Cell 的研究全面分析了CRISPR-Cas9诱导的原代人T细胞染色体缺失的频率和后果,采用基因组规模的方法了解影响这种现象的具体机制,并研究了临床前和临床T细胞疗法。这些综合研究表明,尽管染色体缺失是位点特异性CRISPR-Cas9基因组编辑的普遍后果,但新的方案和对潜在机制的进一步探索可以最大限度地减少其发生和影响。
论文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00975-3
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。