一种高效的基因敲入技术——SLEEK
基于细胞疗法的基因编辑技术在治疗严重疾病,如癌症、自身免疫性疾病和血红蛋白病等方面取得了重大进展。在癌症免疫治疗中,带有整合嵌合抗原受体 (chimeric antigen receptor, CAR) 的自体T细胞疗法,即CAR-T疗法,已经改变了对携带CD19或B细胞成熟抗原 (B cell maturation Antigen,BCMA) 的恶性肿瘤的治疗。其余改造的免疫细胞,如自然杀伤 (natural killer,NK) 细胞,通过基因组插入目的基因,如靶向肿瘤抗原的CARs系列基因,改善抗体依赖性细胞毒性的CD16基因和改善持久性的膜结合白细胞介素-15基因,也显示出对癌症免疫治疗的希望【1-3】。
最近几年,通过使用CRISPR-Cas等基因编辑技术,在基因组中插入基因片段,已从最初的γ逆转录病毒和慢病毒载体的随机整合,发展到了靶向、位点特异性的精确插入。尽管如此,相当大的挑战依然存在;如AAV6 (Adeno-associated virus serotype 6, AAV6) 病毒载体容量受限,须小于4.7kb。此外,尽管为提高同源性定向修复 (homology-directed repair, HDR) 效率做出了巨大努力,但在大多数容易的细胞类型中,敲入的发生率通常限制在60-70%。在各种细胞类型中实现接近100%的敲入效率是CRISPR-Cas的主要挑战,因为细胞强烈倾向于通过非同源末端连接 (non-homologous end joining,NHEJ) 对核酸酶诱导的双链断裂 (double-strand breaks, DSBs) 进行修复;而不是同源性定向修复【4-5】。那么,要如何克服这些挑战呢?

2023年5月1日,来自美国马萨诸塞州波士顿市剑桥区,Editas Medicine公司的John Zuris团队,以Article形式在Nature Biotechnology 杂志上,发表了题为A highly efficient transgene knock-in technology in clinically relevant cell types的文章,报道了该团队开发的一种名为SLEEK的基因敲入技术;SLEEK采取在必需基因最后一个外显子进行巧妙设计,不仅保留了必需基因的全部功能,提高了同源性定向修复的敲入效率至90%左右;该技术还实现了在单一插入大片段中同时包含表达4个不同基因的序列,使得载体容量增加至5kb。

为了克服基因编辑技术载体容量小、插入效率低的挑战,该团队尝试设计一种技术,称为SLEEK (SeLection by Essential-gene Exon Knock-in)。SLEEK设计理念是:采用HDR的方式,在必需基因,如酸甘油醛脱氢酶GAPDH,TBP (TATA-binding protein) 及KIF11 (kinesin family member 11),的最后一个外显子进行目的DNA片段插入,同时保留必需基因的全部功能;如下图示。
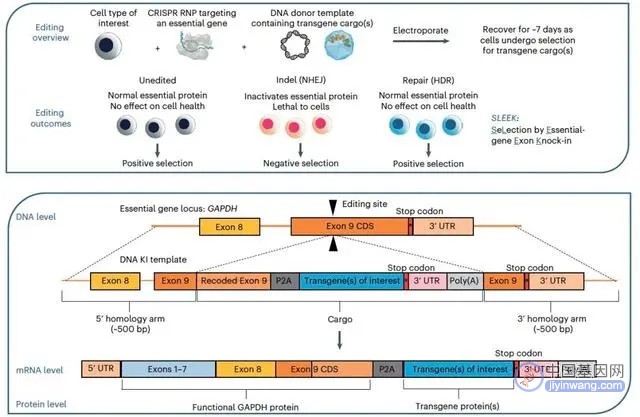
紧接着该团队在诱导型多能干细胞 (induced pluripotent stem cells, iPSCs) 中,验证SLEEK的可行性。他们在GAPDH, TBP及KIF11的最后一个外显子,插入带有绿色荧光蛋白(GFP)的目的基因DNA序列(Cargo);并在一周之内使具有GFP表达的细胞数目从11%升至93%。进一步的ddPCR及流式细胞数据显示GAPDH最后外显子插入效率为92%,TBP最后外显子插入效率为80%,KIF11最后外显子插入效率为82%。
随后该团队进行了大跨度大范围的验证。他们验证了SLEEK除CRISPR-Cas核酸酶外,与其余核酸酶的兼容性;他们发现SLEEK也能兼容SpCas9。此外他们在DNA模版样式、敲入序列基因数目容量、临床治疗常用细胞类型、脱靶效率等方便进行了验证,数据显示SLEEK插入Cargo可以是各式各样的DNA模版,单链或双链的,环状的或线性化的;可最大实现同时在一个Cargo里表达4个不同基因;脱靶概率可忽略不计;并且在各种临床治疗类型的细胞,如T细胞,B细胞,NK细胞及iNK (iPSCs-derived NK) 细胞中,持续性实现目的基因的较高敲入效率。
最后,该团队在体外与体内分别对SLEEK的治疗效果进行了评估。他们在iNK细胞中双插入CD16及mbIL-15 (SLEEK DKI iNK)。在体外,他们用上述治疗细胞对卵巢癌细胞系SKOV-3进行处理;试验数据表明,使用SLEEK DKI iNK细胞进行处理,能够有效的杀死SKOV-3卵巢癌细胞。在体内,他们对卵巢癌模型小鼠进行了处理;在曲妥单抗存在的情况下,SLEEK DKI iNK细胞处理使癌症组织边界显著减小,并在第11天观察到最大响应;而且SLEEK DKI iNK细胞在处理后的第54天仍能维持较高的疗效。经过114天的治疗,仅用曲妥单抗处理小鼠的存活率为37.5%;结合SLEEK DKI iNK细胞处理后小鼠的存活率为100%,且经SLEEK DKI iNK细胞处理后,小鼠体内的癌细胞几乎完全消失。
总之, SLEEK技术的最大亮点是克服了基因编辑技术同源性定向修复敲入效率低的挑战;同时把载体容量升高至5kb。此外,SLEEK具有治疗细胞类型广泛,插入目的基因可以是各式各样的DNA模版样式,CRISPR核酸酶兼容性大,脱靶概率极低及可同时插入4不同基因等优点。本文体外数据范围跨度广,其分析囊括了基因编辑技术的诸多方面。唯一不足的是疗效评估数据偏少,仅有一种癌细胞的治疗数据。
原文链接:https://www.nature.com/articles/s41587-023-01779-8
参考文献
1. Bailey, S. R. & Maus, M. V. Gene editing for immune cell therapies. Nat. Biotechnol. 37, 1425–1434 (2019).
2. Raffin, C., Vo, L. T. & Bluestone, J. A. Treg cell-based therapies: challenges and perspectives. Nat. Rev. Immunol. 20, 158–172 (2020).
3. Raje, N. et al. Anti-BCMA CAR T-cell therapy bb2121 in relapsed or refractory multiple myeloma. N. Engl. J. Med. 380, 1726–1737 (2019).
4. Eyquem, J. et al. Targeting a CAR to the TRAC locus with CRISPR/Cas9 enhances tumour rejection. Nature 543, 113–117 (2017).
5. Zhang, L. et al. AsCas12a ultra nuclease facilitates the rapid generation of therapeutic cell medicines. Nat. Commun. 12, 3908 (2021).
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。