Science子刊:宾大团队利用LNP-mRNA实现胎儿脑内基因编辑
今年7月,宾大研究团队一篇题为Ionizable Lipid Nanoparticles for Therapeutic Base Editing of Congenital Brain Disease的文章进一步研究了LNP 作为围产期大脑中基因编辑平台的递送载体对于遗传性CNS (中枢神经系统疾病)的适用性,为在围产期或刚出生的婴儿进行一次性单基因疾病治疗提供了脑内编辑的可能性。
单基因遗传病是导致新生儿出生缺陷的主要原因之一,目前大约有7000到10000种先天性疾病与单基因突变有关,其中约有17%会累及神经系统,包括神经发育迟缓、运动和认知功能障碍以及原发性神经元变性等多种先天性脑疾病。对于神经系统先天性疾病不仅缺乏特异性诊断指标,更缺乏相应的治疗方法,且往往在胎儿降生前便已发病,几乎没有逆转的可能,所以临床上多以减轻症状或控制疾病进展为主。
基因编辑技术助力单基因疾病治疗
随着基因技术的发展,诺奖级基因编辑技术CRISPR-Cas9和碱基编辑平台等相继出现,让科学家对于单基因遗传病的彻底治疗产生了新的想法。早在2019年,费城儿童医院(CHOP)和宾夕法尼亚医学院的一个研究小组就利用CRISPR基因编辑技术,在一种动物模型中成功地阻止了一种致命的肺部疾病的发生,并将研究结果成功发表在了Science Translational Medicine上。虽然这只是概念验证性研究,但基因编辑技术在妊娠中晚期以及不可逆病理过程中治愈或减轻疾病的能力是非常令人兴奋的。
天使综合症(Angelman syndrome)是携带缺陷的母亲UBE3A基因的婴儿会患上的一种目前无法治愈且治疗非常有限的严重神经发育障碍。2020年10月,Nature一篇研究报告显示,科学家们通过CRISPR-Cas9基因疗法等技术修补子宫内胎儿大脑的错误突变,恢复人类神经元培养物中UBE3A基因的功能,能有效甚至可能是永久治疗Angelman综合征模型的缺陷。研究者还证明,这种方法在培养的人类神经元中被证实是有效的。这项研究结果不仅为后期科学家们治疗Angelman综合征提供了重要基础,同时也为治疗其它单基因障碍开辟了道路。
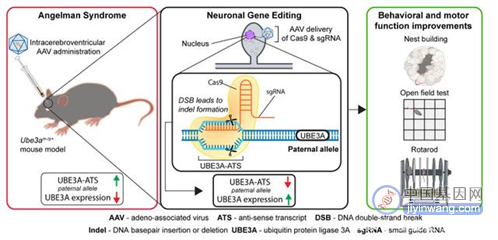
▲AAV介导CRSPR/Cas9对UBE3A-ATS的敲除恢复UBE3的表达 (图片来源:DOI:10.1172/JCI142574)
“天使大作战”中,研究人员是利用腺相关病毒(AAV)基因疗法将Cas9蛋白运输到Angelman综合征胚胎小鼠模型的大脑中的。虽然多项概念验证实验中递送mRNA的载体系统靶向肝脏和心脏的效果明显,但多在靶向中枢神经系统上缺乏有效性。并且,以AAV为代表的载体系统通常会存在基因编辑工具尺寸的限制,特别是在胎儿个体中使用需要慎重考虑病毒免疫和载体整合风险。
非病毒载体递送平台LNPs可以实现定点插入,避免随机整合,从而提高基因药物的安全性;在靶向递送mRNA药物的同时可以解决其短时间降解、反复给药与表达阈值要求较高等问题。只要针对预期目标进行设计,就能发挥LNP的模块化优势。
2021年,来自宾大研究团队开发了一种子宫内mRNA脂质纳米颗粒(LNP)递送系统,在怀孕小鼠中验证了其筛选的LNP可安全实现子宫内递送mRNA,并善体内胎盘mRNA的递送效果。该研究为将来针对产前诊断出的遗传性疾病开发新的潜在疗法奠定了基础,验证了通过脐静脉注射递送mRNA至围产期小鼠胎儿肝脏、肺和肠道进行基因编辑治疗的可行性,但该研究还未验证其在中枢神经系统中的递送效率。
LNP递送mRNA进行脑内基因编辑新突破
今年7月,宾大研究团队在进行体内LNP文库筛选确定围产期小鼠脑中表现最佳的LNP 的细胞取向后,针对 LNP 配方进行体外优化,然后使用优化的 LNP递送胸腺嘌呤碱基编辑(ABE) mRNA和合成指导RNA(sgRNA),通过侧脑室(ICV)注射方法在小鼠模型中纠正了IDUA的致病单基因突变,成功介导了LNP的靶向基因编辑治疗和对递送载体最小的免疫应答。
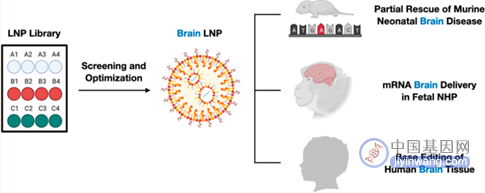
▲ 实验内容导图
在空白对照组的比对下,宾大团队设计的LNP载体不仅对大脑的靶向性良好,在心脏、肺、肠、肝、脾或肾中均无显著的表达,而且无论哪种LNP在大脑内均可观察到相似的全脑分布:仅在脑室、邻近星形胶质细胞和对大脑内部结构渗透有限的神经元中的表达,且并不具备向脑室周围间隙外的脑实质深处扩散的迹象。研究人员针对前阶段实验表现最好的C3 LNP进行了参数上的进一步优化,实验发现,封装的mRNA和sgRNA的比值为3:1时可获得最好的基因编辑水平,但N:P值10:1上调至20:1时,虽然表现更好的脑神经母细胞递送效率,但毒性有所增强。
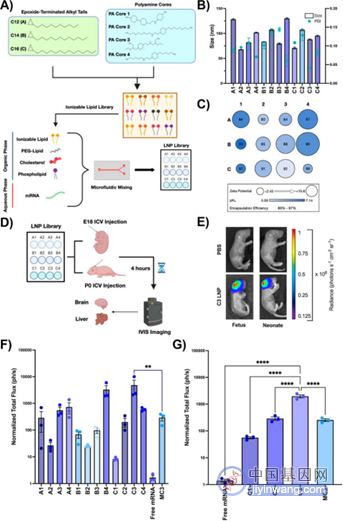
▲围产期脑mRNA递送LNP 文库的设计与评价
此外,该团队还进一步在食蟹猴胎儿和人类脑脊髓液(CSF)中验证了其优化后LNP配方的转染效率,结果表明:C3 LNPs的尺寸大小和多分散性均无显著变化,稳定性可维持一周;C3 LNPs的转染效率较高,且对细胞的活力没有显著影响;C3 LNPs在围产期胎儿大脑中的mRNA递送效率,可转化到更大的动物模型中,并仍有进一步优化的空间。
总结
单基因遗传病作为只有一对等位基因控制的遗传病,看似只改变了属于2-3万个组成的人类基因的基因之一,但表现出的结果却是生命无法承受之重。对于进行基因治疗的研究来说,既有足够简单、精确的目标,又对编辑技术的靶向性和准确性提出了极高的要求。2023年7月,宾大研究团队还在Science发表了基于mRNA-LNP的造血干细胞基因编辑疗法,克服了体外基因编辑造血干细胞疗法的风险,使基因编辑疗法如同打疫苗一样简单,也让越来越多的罕见病患者看到了希望的曙光。
随着2018年“基因编辑婴儿”事件轰动全球,基因编辑技术始终面临着对伦理问题的质疑。“转基因”的安全未知性和后果不可控性,让人们始终对于生命的尊严保持敬畏,也对过于激进的基因疗法表现天然地排斥。但只要不断完善技术规范和遵守伦理的底线,在生命伦理的框架中进行研究和进步,合理利用基因编辑也确实可以有效的对部分医学难题进行有针对性的解决,化解某些人类不可控的原有危机,并对生命的奥秘实现进一步的探索。
每一个罕见病的孩子都被看作是被上帝派来揭示基因秘密的“天使”,在新型药物研制过程中,尤其是对于在孕妇,胎儿群体中使用的生物制品的安全性一定要进行认真的审视与监督,在保障无严重不良反应和影响的情况下加深对药物及机制的了解。相信在基因编辑技术的不断发展与靶向递送技术的不断优化下,基于LNP递送系统的基因编辑疗法终将有一天会从小鼠实验迈向临床,最终造福于那些被命运选中的“天使”。
参考资料:
1.https://doi.org/10.1021/acsnano.3c02268
2.https://doi.org/10.1021/jacs.2c12893
3.https://doi.org/10.1038/s41586-020-2835-2
4.https://doi.org/10.1126/science.adj0997
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。