研究揭示DNA柔性在抗体基因超突变中的生理功能
4月24日,《细胞》(Cell)以Research Article的形式,在线发表了中国科学院分子细胞科学卓越创新中心孟飞龙研究组等撰写的题为Mesoscale DNA Feature in Antibody-Coding Sequence Facilitates Somatic Hypermutation的最新成果。该研究基于经典生化方法与高通量测序技术,建立了体外检测抗体基因超突变的一系列新方法,从而揭示了抗体基因互补决定区(CDR)通过高度柔性特征引发超高突变的分子机理。胞苷脱氨酶AID在B淋巴细胞中启动了抗体基因超突变,其蛋白表面具有大片正电荷片区;而抗体基因CDR编码区域DNA序列则在进化中获得了高度柔性的特征。酶与底物的协同进化共同促进了CDR区的超突变偏好。该工作为下一代抗体基因人源化动物模型的设计提供了底层理论。
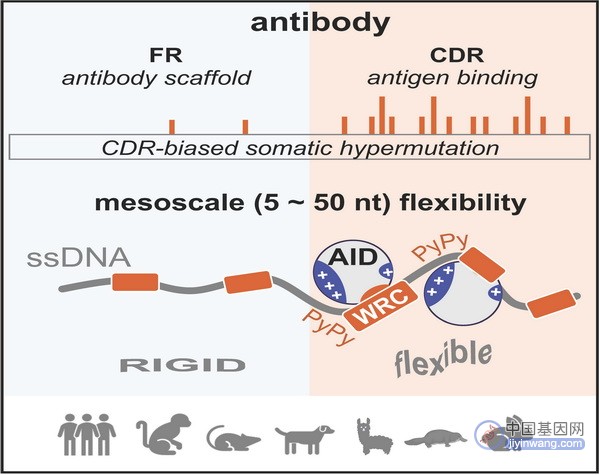
抗体作为适应性免疫系统中的关键效应分子,时刻守卫着机体的健康。面对复杂多变的外界环境,机体的免疫系统通过抗体多样化机制产生数量庞大的抗体分子,从而特异性地识别和清除病原体。抗体多样化通常包含两个主要步骤:一是核酸内切酶RAG介导的的V(D)J重排过程,二是胞苷脱氨酶AID起始的体细胞超突变(SHM)和抗体类型转换(CSR)过程。体细胞超突变可在抗体基因的可变区编码区引入高频突变。然而,超突变在抗体可变区外显子上并非均匀分布,而偏好性积累在可变区中的互补决定区(CDR)。超突变为什么具有偏好性,这是免疫学家David Baltimore与Klaus Rajewsky在20世纪80年代提出的问题。近40多年来,该领域的科学家尝试从多个角度去解释这一现象,但尚未有令人信服的结论。CDR偏好突变科学问题的解决亟需引入新的概念。胞苷脱氨酶AID是一个仅含198个氨基酸的蛋白质。生化实验证明,AID作用于单链DNA底物,且偏好作用于WRC(W=A/T, R=A/G)基序。然而,WRC基序不能解释抗体基因CDR偏好超突变,这是由于同样的WRC基序在CDR编码区突变率超高。在CDR编码区的中尺度(5-50bp)中,AID可能受到局部序列的调控。
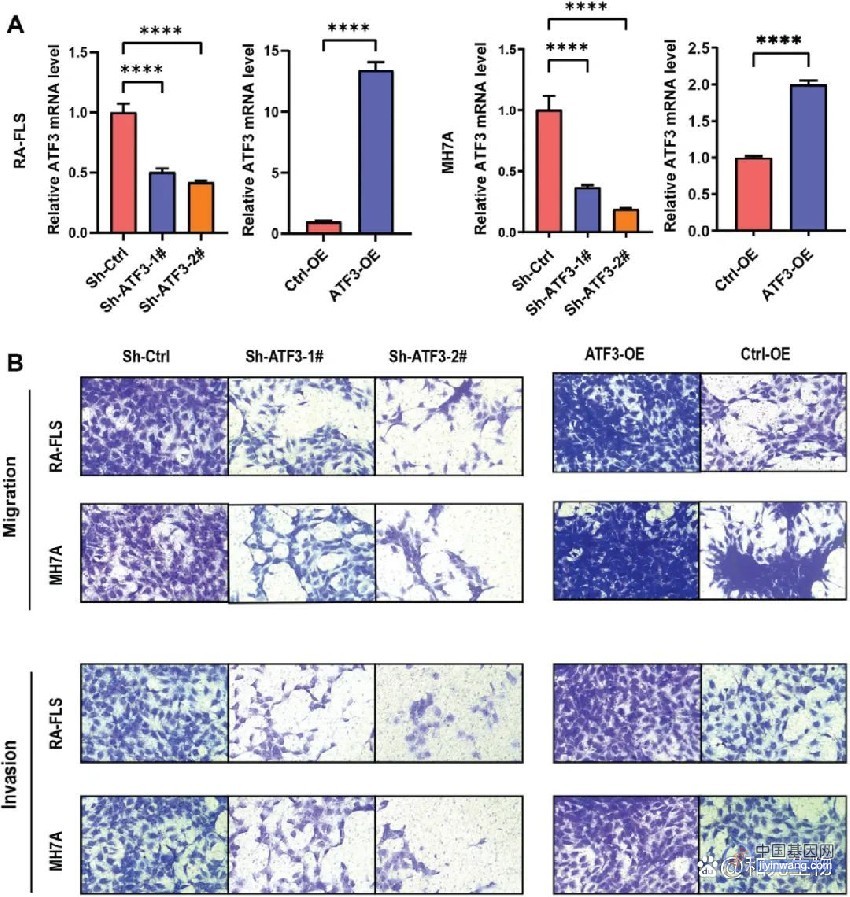
孟飞龙研究组长期致力于免疫受体多样化机制研究。在最新研究中,科研人员从经典的生化方法出发联合高通量测序技术,建立了体外检测抗体基因突变的新体系,发现了AID酶活反应重现小鼠体内抗体基因突变谱式。进一步,该研究将生化实验的DNA底物扩展到27种有颌脊椎动物的1000余条抗体基因序列,发现CDR突变偏好在使用体细胞高频突变(SHM)作为抗体主要多样化策略的四足动物(包括人、恒河猴、食蟹猴、小鼠、大鼠、狗、鸭嘴兽以及羊驼等)中高度保守。那么,这种突变偏好是否受DNA序列上下文的影响?
为了回答上述问题,研究人员在小鼠体内将一段抗体基因的DNA序列进行随机置换,发现序列改变后突变频率发生了显著变化。这提示不同的DNA序列上下文中可能含有未知的中尺度顺式因子,从而调控突变频率的作用。因此,研究通过基因编辑在CDR3区引入随机序列改变,快速获得十几种携带不同CDR3序列环境的小鼠模型,发现了序列改变越靠近CDR3区内的突变热点对该位点的突变频率影响越大。因此,研究继续将序列上下文范围缩小到突变位点上下游各12-15 nt。
通过分子动力学模拟和多种单分子生化实验,研究发现中尺度中DNA序列柔性越大越利于结合AID表面的正电荷片区,进而越有助于突变的发生。单链DNA的柔韧性与嘧啶-嘧啶二核苷酸的含量呈正相关。此外,通过分析抗体基因序列特征以及突变谱式,研究发现抗体基因CDR的编码序列在进化中获得了高度柔性的特征。科研人员分别在B细胞系和小鼠体内将一段柔性序列插入突变低频区FR,发现柔性序列提高了FR的突变频率。
综上,该研究解答了长期困扰这一领域的难题,发现了抗体基因CDR编码区DNA柔性促进偏好性突变的发生以及抗体基因编码序列具有调控AID突变靶向的非编码功能。这一工作为DNA力学性质参与调控细胞生命过程中提供了例证,并提示DNA柔性等力学性质可能在其他生命活动如肿瘤的发生发展中发挥重要作用。中尺度序列特征的发现,为设计下一代抗体基因人源化动物模型构筑了底层理论。
该研究由分子细胞卓越中心和上海交通大学医学院合作完成。上海师范大学科研人员在数据分析,上海交通大学科研人员在分子动力学模拟,美国哈佛大学科研人员在模型构建等方面作出了重要贡献。研究工作获得国家自然科学基金、科技部、中科院、上海市科学技术委员会等的资助,并得到上海交通大学、美国哈佛大学医学院、中国农业大学、瑞典卡罗林斯卡研究所、中科院杭州医学所、中科院生物物理研究所和复旦大学等的科研人员以及分子细胞科学卓越创新中心动物实验技术平台、细胞分析技术平台和分子生物学技术平台的支持。
DNA柔性在抗体基因超突变中的生理功能
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。