细胞身份基因的调控新机制,以实现RNA表达的精确调控
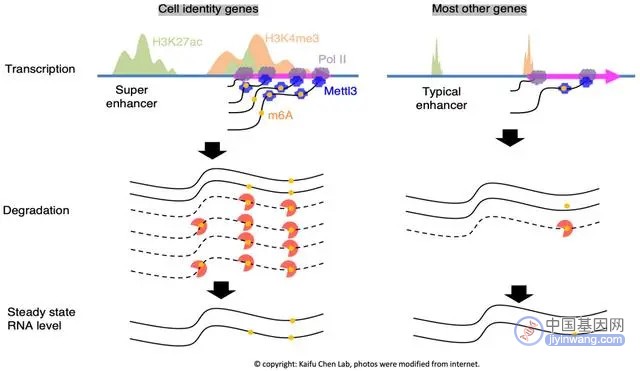
细胞身份基因在表观遗传机制激活转录方面与其他基因有所不同,例如受超级增强子和宽域的H3K4me3修饰调控。然而,之前尚不清楚它们的转录后调控是否也具有独特性。
2023年5月1日,哈佛大学医学院/波士顿儿童医院陈开富课题组与西北大学曹圻课题组在Nucleic Acids Research在线发表题为 Low RNA stability signifies increased post-transcriptional regulation of cell identity genes 的研究论文。

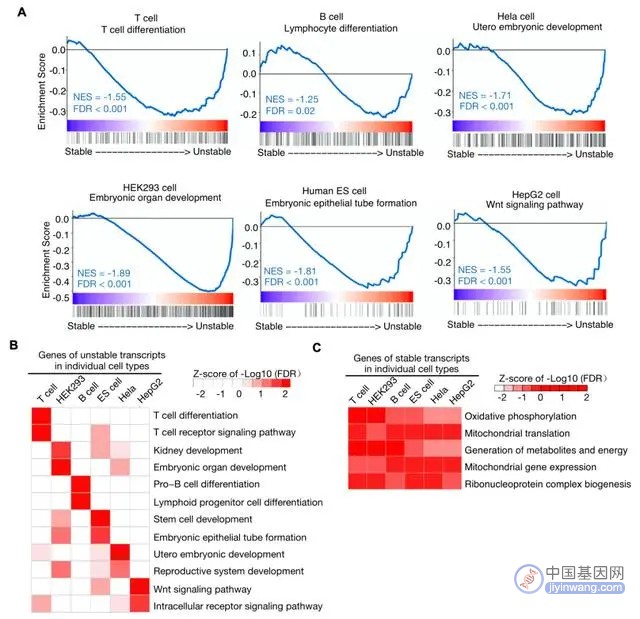
陈开富实验室持续长期专注于研究细胞身份基因的独特表达调控机制。在本文报道的最新研究中,李岩强等对多种细胞类型的RNA稳定性数据进行了系统分析,发现不稳定的转录本富集在与细胞身份相关的信号通路中,而稳定的转录本富集在负责基本生命维持的信号通路中。对RNA稳定性和染色体表观修饰的分析表明,稳定性较低的RNA的基因位点富集超级增强子和宽域的H3K4me3修饰。有趣的是,分析RNA m6A甲基转移酶METTL3在染色质上的结合位点发现,METTL3富集在超级增强子、宽域H3K4me3及它们调控的基因区域。METTL3在染色质上的结合强度与RNA m6A甲基化呈正相关,与细胞身份基因的RNA稳定性呈负相关,这可能是由于伴随转录过程而发生的RNA m6A修饰促进RNA在转录后的降解过程。基于Nanopore的直接RNA测序显示,METTL3的敲低对细胞身份基因的mRNA m6A修饰和mRNA稳定性具有更强的影响。该论文揭示了一个“run-and-brake”模型,即细胞身份基因经历着频繁的转录和快速的RNA降解,以实现RNA表达的精确调控。
mRNA稳定性的调控是基因转录后调控的重要组成部分,研究mRNA稳定性对于开发高稳定性的RNA疫苗和基因治疗具有重要的意义。该研究通过对RNA稳定性数据的系统分析,发现细胞身份相关的基因RNA稳定性很低,而house keeping基因的RNA稳定性很高。进一步的不同类型的RNA稳定性数据分析表明,不同细胞类型的细胞身份基因的RNA稳定性都很低并且具有细胞类型特异性,而housekeeping 基因在所有的细胞类型中稳定性都很高。该发现表明,和house keeping基因相比,细胞身份基因受到更多的转录后调控。
以往的研究表明细胞身份基因具有独特的表观遗传学特征,即倾向被超级增强子(super enhancer)、宽域H3K4me3修饰(broad H3K4me3)所调控。本文中的最新发现表明细胞身份基因的RNA稳定性很低,却具有很高的转录活性以及H3K27ac和H3K4me3 修饰信号。陈建军和何川团队曾揭示METTL3 和转录酶Pol II 相互作用,并且具有共转录修饰mRNA上的m6A的作用。通过METTL3的ChIP-seq数据分析发现, METTL3 在细胞身份基因上具有更多的结合信号,并且细胞身份基因mRNA的m6A修饰和其它基因相比更丰富,表明mRNA的m6A修饰是调控细胞身份基因RNA稳定性的重要因素。
利用Nanopore(纳米孔)直接RNA测序方法对T细胞对照和METTL3 敲低样本mRNA测序分析发现,和house keeping基因相比,T细胞细胞身份基因的m6A信号更强,RNA稳定性更低,并且更易受到METTL3 敲除的影响。
最后,利用上皮细胞诱导干细胞分化的模型研究发现,伴随细胞身份的转变,细胞身份基因的m6A 修饰以及RNA稳定性也经历了重塑。该研究首次揭示了一个细胞身份基因的刹车调控机制,即细胞身份基因同时经历着高速转录以及高速RNA降解的过程,以实现细胞身份基因表达的精准调控。
美国哈佛大学医学院/波士顿儿童医院陈开富,张丽丽以及美国西北大学曹圻为此研究的共同通讯作者。李岩强(哈佛大学医学院/波士顿儿童医院 Instructor),易旸(美国西北大学医学院 Research assistant professor)为论文的共同第一作者。李岩强负责该论文生物信息学分析部分包括RNA稳定性,ChIP-seq,m6A-seq, 以及纳米孔测序多组学数据的分析和整合。易旸负责论文的纳米孔测序以及RNA稳定性的实验验证。
原文链接:https://doi.org/10.1093/nar/gkad300
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。