「性别选择」成为现实?基因编辑技术CRISPR可100%控制后代性别
在农民伯伯的理想世界中,所有的鸡都是会下蛋的母鸡,所有的牛都是会产奶的母牛,所有的猪都是会下崽的母猪……
雄性表示:我们除了被吃,难道真的“一无是处”了吗?(瑟瑟发抖)
——也许,是的呢!(扎心)
——而且,有些时候,过剩的雄性还会被扑杀,以减少精力和降低成本。(再来一刀)

Figure 1 (图片来源:Pixabay)
农业领域尚且如此,更不必说科学研究了。
譬如,在进行生殖系统、卵巢癌或前列腺癌等性别特异性研究的过程中,某一特定性别的实验动物必然备受(实验经费告急的)研究人员的青睐。而被剔除在外的那窝小崽子,只能等着“被处理”;当然,现代科技也可以在前期通过精子种类筛选或是杀死特定性别的胚胎,于一开始就避免某种性别的幼崽出生。
但是,饲养、培育、扑杀,每一个环节都会带来经济(和情感?)的负担。所以,若能从一开始就让动物们产生人们所需要的特定性别的后代,显然能够在很大程度上解决上述困扰。
——嗯。那就来想办法吧!
近日,来自英国弗朗西斯•克里克研究所(The Francis Crick Institute)的科学家与肯特大学(University of Kent)的研究团队合作,利用CRISPR-Cas9技术,竟让实验小鼠按人们的预期产下了一窝全是雌性或一窝全是雄性的小鼠幼崽,而且成功率高达到100%!更重要的是,据研究人员表示,这种方法不仅适用于老鼠,或许还能推广到其他物种,包括鸟类和鱼类。
该研究成果以“CRISPR-Cas9 effectors facilitate generation of single-sex litters and sex-specific phenotypes”为题[1],于12月3日在线发表在《自然-通讯》(Nature Communications)上。

图片来源:Nature Communications
为了实现让小鼠完成只生产特定性别后代的目的,研究人员设想的方案是:在鼠妈妈的胚胎发育的早期阶段,就设法消除其体内另一性别的胚胎,只允许想要的性别发育。
在此次的研究中,目光被锁定在了Topoisomerase 1基因(Top 1)*上。为了只在雄性胚胎或只在雌性胚胎中靶向地“剪”掉Top1基因,聪明的研究人员设计了一个十分巧妙的方案:把组成CRISPR-Cas9基因编辑系统的两个元素——sgRNA(用以识别特定DNA序列,这里即Top1,由所有胚胎继承)和Cas9(用以切割DNA,视情况继承)——分别植入鼠妈妈的基因组和鼠爸爸的某一条染色体中。一旦精子与卵子结合,sgRNA与Cas9就会在同一细胞中相遇,于受精卵内形成并合力触发CRISPR-Cas9,从而成功“剪”掉Top 1基因。
*注:Top1基因编码拓扑异构酶,在DNA复制和修复过程中扮演着不可或缺的催化作用。在受精卵不断分裂并发育成胚胎的过程中,若是“剪”掉这个基因,那么胚胎将很快停止发育并迈向死亡。
具体而言,当所需后代鼠崽为雌性时,就将Cas9植入鼠爸爸的Y染色体,于是,当雄性胚胎发育到约16~32个细胞的非常早期的阶段时,就无法再继续发育;反之,若是在鼠爸爸的X染色体上插入Cas9,则只有雌性会继承这种突变,鼠妈妈则会产下均为雄性的后代鼠崽。当然了,这一切完全取决于科研人员的期望性别是什么。

Figure 3. 通过CRISPR-Cas9敲除Top1后,成功控制性别的新生小鼠(图片来源:The Francis Crick Institute)
更重要的一点是,此项基因编辑对小鼠幼崽的健康没有任何副作用[2],它们可以继续生育自己的后代,且这些后代拥有自然的50/50的性别比例;当然,若是选择继续跟含有CRISPR代码的另一半交配,则可以继续拥有单性别的第三代、第四代、第五代……
除此之外,科学家们还观察到另一个让他们意外的结果:在减少“不被需要”的胚胎后,小鼠母亲生下的幼崽数量比原本预计的要多!
凭借我们的想象,既然一半的胚胎没有发育,那理论上这种方法应该导致子代数量减少50%才是吧?
不不不,大自然是奇妙的——实际中,实验小鼠的后代数量是对照组的61%~72%,只减少了25%左右!研究人员分析认为,一种可能的原因是由于植入子宫的胚胎数量减少,所以鼠妈妈就把有限的资源留给了幸存下来的“正确”胚胎。这使得它们能够“茁壮成长”并提高了存活率。所以如果这项技术将来被实际应用,还需要温馨提醒使用者们注意减少用于繁殖的动物数量,以免“产能过剩”。
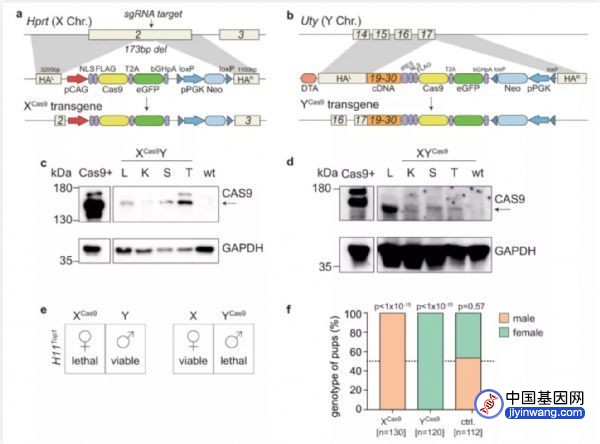
Figure 4. 通过编辑鼠爸爸的X/Y染色体,得到单性别的后代(图片来源:Nature Communications)
另外一点,就如前文所说:由于Top1基因在哺乳动物中具有良好的保守性,这一结果可能也适用于其他动物。因此难免会有人担心,这种控制出生性别的方法是否会被用于人体呢?
对此,以色列特拉维夫大学(Tel Aviv University)的基因编辑专家Ehud Qimro教授表示,还请大家放心。这种技术更适合单次产仔量大、妊娠期短的物种,比如小鼠(它们在交配三周后通常一次可产多达12个幼崽);此外,该方法需要对基因进行修改,无论是伦理还是实操,在人类身上都不切实可行[3]。
说到这里,还请善待你身边的那几只小白鼠,毕竟在你日夜赶due时,只有它们不离不弃地默默陪伴着你,所以
——它们都这么对你了,人家的“终生大事”让你操心一下又怎么了?!
References:
[1] Nature Communications:CRISPR-Cas9 effectors facilitate generation of single-sex litters and sex-specific phenotypes https://doi.org/10.1038/s41467-021-27227-2
[2]The Francis CricK Institute:Gene-editing used to create single sex mice litters https://www.crick.ac.uk/news/2021-12-03_gene-editing-used-to-create-single-sex-mice-litters
[3]Science News:Gene editing produces all-male or all-female litters of mice doi: 10.1126/science.acx9764
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。