Science子刊:程涛团队等首次解析异基因造血干细胞移植患者造血再生规律

造血干细胞移植(HSCT)通过输注造血干/祖细胞(HSPCs)和单个核细胞,重建移植患者的血液系统进而维持终生造血,已成为多种良恶性血液系统疾病和免疫疾病的常规治疗方式。通常自体HSCT(auto-HSCT)患者可在6-12个月后完成免疫系统重建,而接受异基因HSCT(allo-HSCT)的患者免疫环境更为复杂,重建过程同时由供受者匹配情况、受者原发疾病以及移植相关的多种因素影响,且移植后患者需要经历长时间免疫功能缺失,T细胞和B细胞缺乏甚至可超过2年,极大的影响患者生存和生活质量。
目前,对于移植造血重建及免疫重建的探索仍局限于细胞数量恢复与预后的相关性以及auto-HSCT体内HSPCs的长期重建。然而,对HSCT尤其是allo-HSCT后患者的各类细胞生态重建及调控机制亟待探索;同时,移植物植入不良(PGF)、移植物抗宿主病(GvHD)等严重并发症仍然缺乏灵敏的预测手段,极大限制了allo-HSCT的应用。
此前,程涛教授团队率先揭示了小鼠造血干细胞(HSC)移植后HSC早期生物学行为的“黑匣子”,随后该团队完成了对人成熟血细胞、胚胎不同发育阶段、成体不同年龄阶段HSPCs的单细胞转录组图谱的绘制,揭示了人稳态下造血的时空规律。然而,移植患者的重建生态是否与小鼠模型一致仍未可知。
基于前期坚实的研究基础,该团队进一步完成了患者从HSCT后第一天到一年的追踪随访,首次对移植患者的生态重建进行纵向剖析。
近日,细胞生态海河实验室程涛教授、郝莎副教授和姜尔烈教授等人在 Science Immunology 期刊发表了题为:Single-cell dissection of human hematopoietic reconstitution after allogeneic hematopoietic stem cell transplantation 的研究论文。
该研究首次刻画了患者经allo-HSCT后体内HSPCs和包括中性粒细胞各阶段在内所有成熟细胞的重建图谱,详细解析了HSPCs在allo-HSCT各阶段的精密调控,为应对allo-HSCT后可能出现的PGF、免疫重建差异和GvHD等提供了可靠的参考基准。

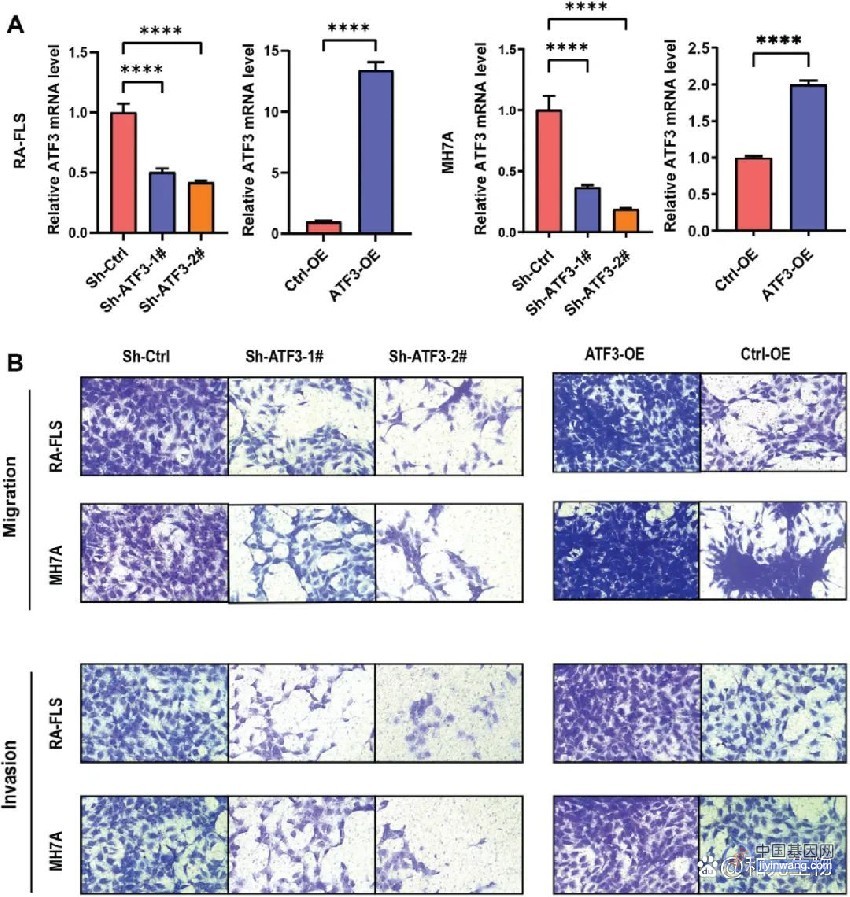
该研究利用了单细胞标记逆转录RNA测序法(STRT-seq)和10×Genomics平台的3’端单细胞转录组测序方法,分别对经流式分选后的Lin-CD34+细胞和总有核细胞(TNCs)进行建库及深度测序,并基于转录组特征对Lin-CD34+细胞分群:共分为HSC/多潜能祖细胞(MPPs),淋系启动的多能祖细胞(LMPPs),巨核红系祖细胞(MEPs),嗜酸-嗜碱-肥大细胞祖细胞(EBMs),B-NK祖细胞(BNKs),单能中性粒细胞祖细胞(NePs)和基质细胞(Stromal cells)等10群。
首先分析了HSPCs在组分上的动力学变化,结果显示供者采集物(Donor)中HSC/MPPs和LMPPs比例显著增加,其占比在移植重建过程中逐渐下降;Donor和移植后第一天(d1)样本中HSPC组分更加相似,造血重建时(d14)和移植后30天(d30)骨髓(BM)中HSPCs构成相似;自移植后60天(d60)起,移植患者HSPCs组成开始出现差异,主要是BNKs所致。
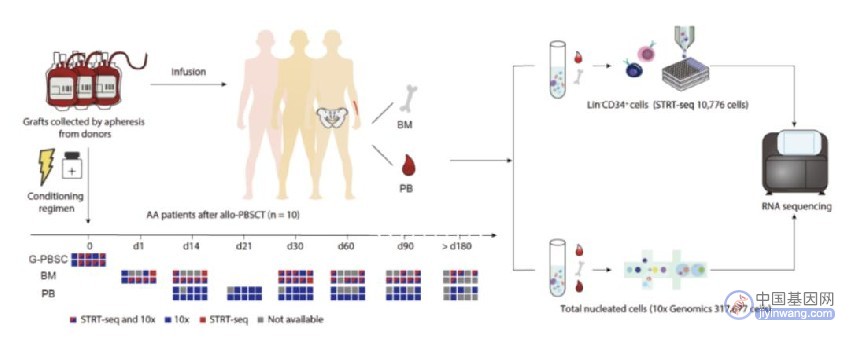
随后,该研究利用全外显子测序中的单核苷酸多样性信息,对6名移植患者移植后的BM/外周血(PB)细胞进行单细胞转录组嵌合分析。在随访中,患者遗留细胞集中于移植后第一天(d1),Lin-CD34+细胞中约有1%的细胞为受者遗留细胞,其中85.7%为基质细胞。在分析中发现了一例在移植后90天,遗留细胞骤增(PB中遗留T细胞占该时间点所有T细胞的36.2%)的特殊病例,该患者进行了全相合移植,且无急性移植物抗宿主病(aGvHD)发生,该病例可能代表了临床中一类极为特殊的患者群体,提示循环中的遗留T细胞可在移植患者体内复现并发挥潜在作用。
接下来,研究人员对HSC/MPPs、寡能祖细胞和中性粒细胞祖细胞进行详细阐释。研究发现,HSC/MPPs表现出巨核-红系偏倚和强烈的增殖倾向。与HSC/MPPs一致,d1捕获到的寡能祖细胞(MEPs、GMPs和EBMs)同样具有强烈的增殖倾向,并在转录组上表现为谱系分化受抑的模式。此外,该研究发现了具有独特免疫调控表达谱的粒系祖细胞——S100Ahigh Neus(包含S100Ahigh Neu1和S100Ahigh Neu2),其在粒细胞集落刺激因子(G-CSF)动员后富集,同时能够在移植患者的HSPCs中持续存在。前瞻性临床队列(n=32)提示,发生aGvHD的患者(n=17)的S100Ahigh Neu2输注量明显少于未发生aGvHD的患者(n=15,P<0.01)。
综上,该研究成果为移植后HSPCs的动力学重建提供了全面的见解和参考,为深入理解allo-HSCT的移植生态提供了宝贵的证据。同时,该研究提出了移植后免疫重建差异的时间窗口和识别aGvHD高危患者的早期预警指标,有助于临床诊疗中对移植患者发生重建不良及aGvHD进行早期诊断和干预,为基础研究向临床应用的转化提供了新角度。
细胞生态海河实验室程涛教授、郝莎副教授和姜尔烈教授为论文共同通讯作者。团队成员霍莹莹、武林杰、庞爱明、李清和洪芳为共同第一作者。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。