Nature重磅:全新基因魔剪Cas12a2来了!
编者按
Cas12a2是一种CRISPR相关核酸酶,在识别互补RNA靶标后,对单链RNA、单链DNA和双链DNA进行RNA引导、序列非特异性降解,最终导致流产感染。
2023年1月4日,美国德克萨斯大学奥斯汀分校分子生物科学系David W. Taylor研究组与美国犹他州立大学化学与生物化学系Ryan N. Jackson研究组合作在Nature 杂志在线发表题为“RNA targeting unleashes indiscriminate nuclease activity of CRISPR–Cas12a2”的研究论文,该研究报道了Cas12a2的二元、三元和四元配合物结构,揭示了一个完整的激活途径。结构表明,Cas12a2是自抑制的,直到结合同源RNA靶标,从而暴露出一个大的带正电荷的裂缝中的RuvC活性位点。双链DNA底物通过双扭曲和局部熔化被捕获,由对双链DNA降解和体内免疫系统功能至关重要的“芳香钳”残基对稳定。
总之,这项工作为这种流产感染机制提供了结构基础,以实现人群水平的免疫,可以利用它来创造合理的突变体,从而降解一系列的附带底物。
另外,2023年1月4日,德国Helmholtz研究所Chase L. Beisel、美国犹他州立大学化学与生物化学系Ryan N. Jackson与美国本森山Matthew B. Begemann合作在Nature杂志在线发表题为“Cas12a2 elicits abortive infection through RNA-triggered destruction of dsDNA”的研究论文,该研究报道了V型单效应核酸酶Cas12a2的RNA靶向通过双链DNA (dsDNA)的非特异性切割驱动流产感染。Cas12a2识别出具有激活原间隔区侧翼序列的RNA靶标后,可以有效降解单链RNA (ssRNA)、单链DNA (ssDNA)和dsDNA。在细胞内,Cas12a2的激活诱导SOS DNA损伤反应并损害生长,阻止入侵者的传播。最后,利用Cas12a2的侧枝活性进行直接RNA检测,证明Cas12a2可以被重新利用为RNA引导的RNA靶向工具。总之,这些发现扩展了CRISPR - Cas系统的已知防御能力,并为CRISPR技术创造了额外的机会。


原核适应性免疫通常使用CRISPR-Cas系统靶向和降解外源遗传元件,包括噬菌体和质粒。然而,最近发现来自Sulfuricurvum sp. PC08-66的Cas12a2反而依赖于流产感染——即休眠或细胞死亡以应对入侵者的存在——来实现群体水平的免疫,阻止质粒的复制和传播。
Cas12a2有时在细菌中与Cas12a系统共存,并且可以使用Cas12a CRISPR RNA (crRNA), Cas12a2识别具有合适的原间隔区侧翼序列(PFS;例如,5 ' -GAAAG-3 ')而不是Cas12a的双链(double-stranded,ds)DNA靶标。此外,Cas12a2对许多靶向Cas12a的抗CRISPR蛋白的作用免疫,并且除了保守的RuvC核酸酶结构域和pre-crRNA加工区域外,Cas12a和Cas12a2序列几乎没有相似之处(大约10-20%的序列相同)。值得注意的是,Cas12a2缺乏一个Nuc结构域(参与DNA靶链加载),而是含有一个锌带(zinc ribbon,ZR),它含有一个独特的插入结构域来代替Cas12a桥螺旋。
与许多最近被描述为流产感染的系统不同,Cas12a2不依赖于二级信使的产生来实现抗噬菌体免疫。相反,Cas12a2的激活诱导了反式中单链(single-stranded,ss)RNA、ssDNA和dsDNA1的强健的非特异性切割。这种机制是Cas12a2所独有的,尽管侧支核酸降解的分子基础尚不清楚。
为了了解Cas12a2功能下的激活、底物捕获和任意核酸酶活性的独特机制,该研究进行了生化、结构和体内分析,包括测定与RNA靶标(三元复合物)相关的自抑制Cas12a2 - crRNA(二元复合物)的冷冻电子显微镜结构,并与RNA靶标和dsDNA副底物模拟物(四元复合物)结合。
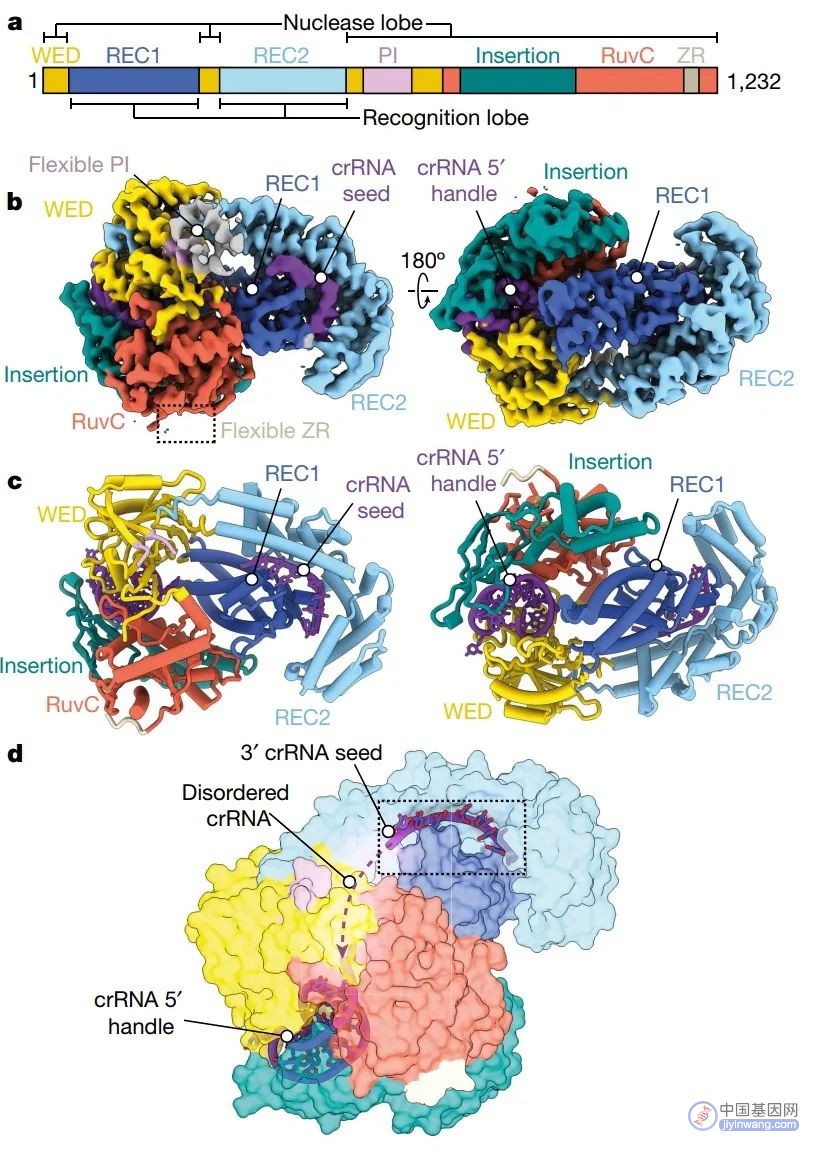
图1. Cas12a2二元复合体类似牡蛎,排列crRNA(图源自Nature )
研究表明crRNA与含PFS的RNA靶标的杂交驱动Cas12a2的主要构象变化,暴露RuvC活性位点并缓解自抑制。在活性复合体中,RuvC结构域位于约30-Å-wide带正电荷的槽内,该槽足够大,可容纳双工核酸。非特异性静电相互作用促进侧基捕获,伴随双工畸变和局部碱基对熔化。熔化的碱基由两对芳香钳稳定,使单个核酸链在RuvC活性位点内的适当定位。这种多次翻转DNA切割最终导致dsDNA降解,不同于Cas12a或Cas9的单次翻转dsDNA切割,并能在体内实现强大和广泛的DNA破坏。
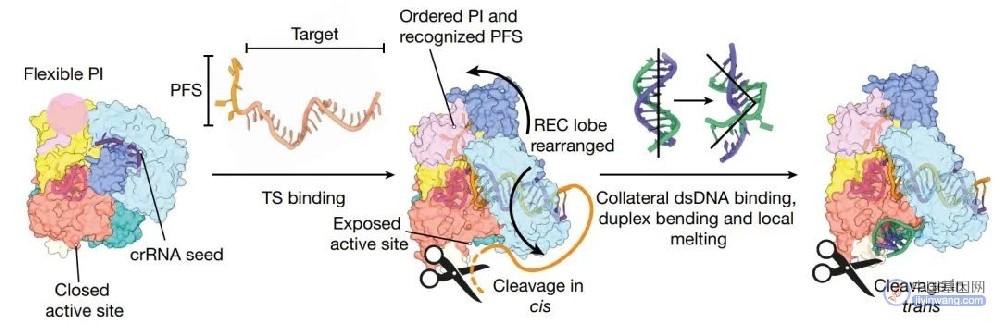
图2. Cas12a2 RNA靶点激活侧支核酸酶活性的机制(图源自Nature )
总的来说,这项研究发现的Cas12a2(Y1069A)点突变体可以切割ssDNA,但不能切割dsDNA或ssRNA,这为一种具有间接活性的RNA传感器提供了蓝图,这种传感器不会破坏被编程检测的RNA目标,也不会被样本中过量的其他RNA分散注意力,这可能会使高灵敏度RNA诊断的发展成为可能。
原文链接:
https://www.nature.com/articles/s41586-022-05560-w
https://www.nature.com/articles/s41586-022-05559-3
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。