Nature子刊:发现一种特殊的基因突变,与儿童肥胖相关

众所周知,肥胖与遗传因素有关,但单基因导致的人类肥胖实际上非常罕见,这些单基因通常是通过影响黑素皮质素受体4(MC4R)通路,该通路主要调控食物摄入与能量平衡。MC4R激活基因位于下丘脑区域,它们激发饱足或不饿的感受。而干扰MC4R激活或发挥功能的变异,与饥饿感持续以及儿童期肥胖有关联。
对这些单基因肥胖特征的检测不仅有助于提高我们对人类肥胖机制的理解,还将指导新的靶向药物的开发。
2022年12月19日,德国莱比锡大学的研究人员在 Nature 子刊 Nature Metabolism 上发表了题为:Aberrant expression of agouti signaling protein (ASIP) as a cause of monogenic severe childhood obesity 的研究论文。
该研究报道了与严重儿童肥胖有关的一种新的遗传机制,基因重排将一个 ASIP 基因拷贝放在了一个启动子旁边,导致了 ASIP 基因高表达,而 ASIP 会抑制MC4R的激活,从而导致了肥胖。而这个与饥饿控制有关的基因异常表达导致的基因重排,在大多数肥胖的常规基因检测中无法被检测到。

通过研究一位患有严重肥胖的青少年女孩组织样本,研究团队发现了一种特定基因,刺鼠信号蛋白基因(ASIP),会在正常情况下本不表达该基因的细胞里高水平表达,这些细胞包括脂肪细胞、白细胞和由个体细胞重编程产生的下丘脑样神经元。
遗传分析表明,基因重排将一个 ASIP 基因拷贝放在了一个启动子旁边,从而解释了为何该基因在每个组织中持续高水平表达。这一已确认的染色体重排的性质,还意味着大多数常规肥胖的遗传形式检测都不会发现它。ASIP 会抑制MC4R的激活,因此在下丘脑细胞中非正常的 ASIP 表达为肥胖提供了可能的解释。
研究团队随后在超过1700名肥胖儿童的队列中特别搜索这一重排,识别出4名携带者(3名女孩,一名男孩),并确认了其中3人的 ASIP 过表达。这一观察与肥胖遗传小鼠(agouti小鼠)模型一致,这一模型中肥胖是由小鼠版本的 ASIP 异常表达引起的。但是,直到现在才发现了人类中与肥胖有关的涉及 ASIP 的类似突变。
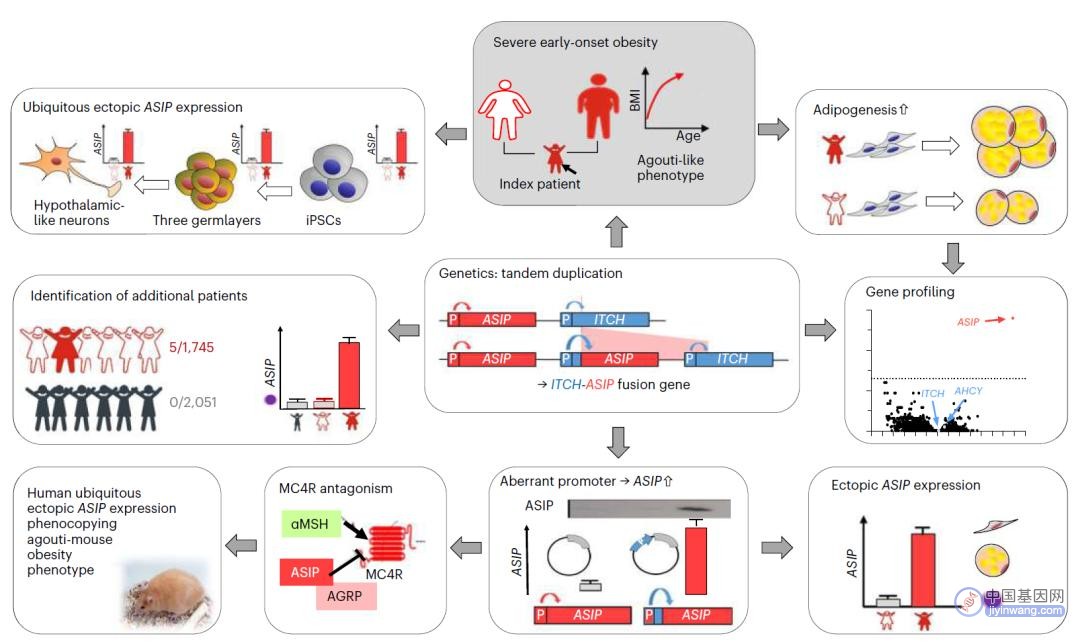
研究团队认为,在测试队列中基因重排的频率较高,需要在其他患者队列中进行额外的定向筛查。虽然在分离细胞中的这些实验支持他们的模型,研究团队指出,该研究尚未确认患者脑中的 ASIP 表达和MC4R抑制。要确定地将基因重排与人类的肥胖相关联,还需要进一步在人类和动物模型中进行研究。
论文链接:
https://www.nature.com/articles/s42255-022-00703-9
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。