Life Med亮点:发明新型基因打靶技术,绘制世界首张小鼠“扰动图谱”

人类基因组序列20多年前已经基本测毕,但其功能至今仍然鲜为人知,基因组大体上仍然是一部天书,这已经成为疾病诊疗的一个巨大障碍。因此,在后基因组时代,生物医学研究的一个主要目标便是破译基因组(尤其是2万个蛋白质编码基因)的功能。实现这一目标的有效策略是对这些基因在每种细胞类型中的表达进行干扰,并描述这种扰动对细胞的直接、内在的影响,即绘制"扰动图谱"(Perturb Atlas)。但不幸的是,现有的基因靶向方法很难适用于扰动图谱的绘制。为了突破这个困境,作者开发了新一代小鼠基因打靶技术iMAP(inducible Mosaic Animal for Perturbation)。 iMAP融合了2大底层技术:基于CRISPR-Cas9的基因编辑技术和基于Cre-loxP的基因重组技术。该技术的核心是一个由多达100个sgRNA编码基因串联而成的转基因。这是一个新型的sgRNA文库,其sgRNA平时不表达,但在药物(他莫昔芬)的诱导下,转基因发生重组,使100个sgRNA都得以在小鼠表达, 但每个细胞只随机表达一个其中一个,后者募集Cas9敲除相应的靶基因,从而将小鼠转化为嵌合体。嵌合鼠可用于普查100个基因在小鼠各种组织细胞的功能,从而绘制扰动图谱,也可以通过简单的配繁,衍生出上百个单基因敲除品系,从而大大降低其制备成本。

本工作首先利用6个功能已知的基因, 作了概念验证实验。结果显示了iMAP的稳健性,而且显示,软件设计的sgRNA大多具有足够的活性和高度特异性,提示可以只用一个sgRNA靶向每个基因。接下来作者构建了一个新品系,靶向90个功能大多未知的基因,并鉴定了这些基因对39种成年鼠组织细胞丰度(反映存活、增殖、分化)的影响, 绘制了世界首张扰动图谱。该图谱提供了关于这些基因的丰富信息, 导致了一系列新发现 (例如发现Hdac7是肿瘤免疫疗法高效靶点)。这张扰动图谱必将催生覆盖全部基因和组织的“全景图”, 后者将有助破译生命天书,并将成为生物医学研究的重要分水岭,因为它使得探索基因基本功能变得像查字典一样简单。
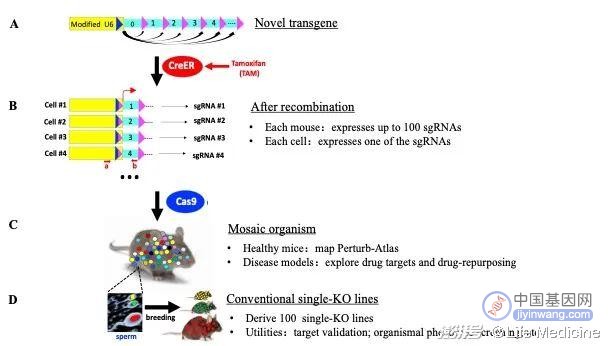
iMAP 的原理
iMAP有多个未来发展方向。首先,iMAP需要优化,因为目前每个品系只靶向100个目标基因, 而且在静息细胞中,基因敲除效率较低 (这可能是Cas9本身的局限性)。其次, 本研究使用sgRNA丰度作为iMAP扰动的readout。然而,单细胞水平的转录组学和表观组学理论上都可作为readout,以更全面地揭示基因功能。此外,iMAP还可与基因敲除之外的其他CRISPR扰动形式相结合,包括基因沉默、激活和RNA降解,后者是探索非编码RNA功能的理想技术。除了在健康小鼠中系统地绘制扰动图谱,在疾病模型中进行的iMAP筛选可助力新药靶发现和老药新用。最后,iMAP可能适用于小鼠以外的其他多细胞生物(包括植物)。
英文全文链接:https://doi.org/10.1093/lifemedi/lnac057
引用本文:Yiwen Sun, Wenyang Lin, Ravinder Kaundal, Tian Chi, iMAPping the Perturb-Atlas, Life Medicine, Volume 2, Issue 1, February 2023, lnac057, https://doi.org/10.1093/lifemedi/lnac057
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。