贺建奎“高才通”事件再发酵,基因编辑技术的进展如何?
近几日,关于贺建奎获批香港“高才通”签证的事件,再次在中国引发巨大舆论争议。随着舆论的发酵,曾因“基因编辑婴儿”被判刑的贺建奎,其高端人才通行证现已被香港政府撤销。2022年4月,贺建奎刑满出狱,之后在北京成立贺建奎实验室,主要从事罕见遗传病的基因治疗研究。
回顾事件,2017年前后,贺建奎的团队使用基因组编辑技术CRISPR-Cas9来编辑胚胎内的CCR5基因,将胚胎植入女性体内,孕育生命,KPI是让患艾滋病的夫妇生儿育女,让其子女及子孙后代受到保护,不感染HIV。2018年11月,这对双胞胎“基因编辑婴儿”提前诞生,但很快双胞胎的各种信息都消失了,这一消息广泛传播,在当时引起了巨大的争议。贺建奎甚至在当年与华为创始人任正非、字节跳动创始人张一鸣一起登上美国《时代》周刊2019全球百大最具影响力的人物名单。
但一些专业人士表示,贺建奎的实验的安全问题还没有得到临床检测,道德伦理问题也还没有被解决,通过创造人类基因编辑婴儿来挑战人类伦理,此举在舆论上受到了国内外的一致谴责。最终,其以非法行医罪,被判处三年并罚款。
01
基因编辑技术发展迅速,为精准医疗提供新思路
基因编辑技术是一种能够对生物体基因组及其转录产物进行定点修饰或者修改的技术,可对特定DNA片段进行敲除、加入和替换等,从而在基因组水平上进行精确的基因编辑。基因编辑技术具有广阔的应用前景,特别是在癌症、心脑血管疾病、遗传性疾病的治疗方面引起极大关注。
基因编辑技术可为慢性疾病患者提供精准药物,改善农业食品供应,提高稀缺生物制品的生产效率,解决气候问题和控制病虫害种群数量等。美国国立卫生研究院(NIH)启动基因组编辑研究项目,旨在大幅加速基因疗法的临床转化,促进癌症和遗传病的治愈;美国国防部(DOD)资助开发CRISPR基因防御性技术,主要研究受到基因武器攻击后的防御性对策。
CRISPR是“成簇规律间隔短回文重复序列”(clusteredregularly interspaced short palindromic repeats)的缩写,原核生物(细菌和古生菌)利用它来防止噬菌体病毒的感染。其原理核心是使原核生物能够识别与噬菌体或其他入侵者相匹配的基因序列,并利用专门的酶将这些序列作为破坏目标,这些专门的酶称为CRISPR相关蛋白Cas(CRISPRassociated proteins)。
我们知道,目前药物的研发周期长且复杂,从临床发现到最终的获批上市,通常需要10-15年才能开发出一个产品,其中在各个环节都存在着很大的失败风险。基因编辑技术通过以更低的成本敲除或修改基因,提供廉价的动物疾病模型和药物测试平台,大幅缩短药物研发周期,有效降低研发成本。通过CRISPR-Cas技术快速构建的动物模型能够提供包括药物功效测试、药物代谢、药物动力学研究以及安全性分析等功能,提高体内外模型的安全性和预测准确度,降低药物研发在临床试验中的失败率。
近几年,基因编辑技术取得了快速的发展和进步,有望在不久的未来实现商业化落地。
2021年11月,英国曼彻斯特大学的科学家开发出利用CRISPR-Cas9基因编辑操纵细菌中关键的装配线酶的新方法,有助于生产急需的改良抗生素,帮助对抗新出现的耐药病原体。
2022年6月,以色列特拉维夫大学的研究人员开发出一种创新的艾滋病疗法,即利用B型白细胞在患者体内进行基因编辑,以分泌针对HIV病毒的中和抗体。该疗法可通过一次性注射击败病毒,极大改善患者病情,或可用于开发成一次性治疗艾滋病的疫苗。
2022年9月,丹麦奥胡斯大学研究团队利用基因编辑技术培育出携带阿尔兹海默症致病基因的克隆猪,可帮助跟踪疾病的早期迹象,并进行早期药物的开发和测试工作,解锁未来的治疗策略。
2022年10月,美国坦普尔大学路易斯·卡茨医学院和Excision生物治疗有限公司联合开展针对艾滋病的新型基因编辑疗法“EBT-101”临床研究,并进行了全球首次人体试验,以评估该疗法的安全性和有效性。EBT-101基因编辑疗法将成为有望改变未来艾滋病治疗的重要里程碑。
2023年1月26日,EMA接受Vertex和CRISPR递交的exagamglogeneautotemcel(exa-cel,研发代号CTX001)上市申请,该疗法通过CRISPR/Cas9编辑患者的CD34+造血干细胞,敲除BCL11A基因红系增强子,以限制性地抑制血红细胞中的BCL11A蛋白表达,从而提升胚胎血红蛋白表达水平,具有一次性治愈潜力。
CTX001获得了FDA授予的再生医学疗法认定(RMAT)、快速通道资格,EMA授予的PRIME认定以及FDA和EMA授予的孤儿药认定。目前在美国已启动上市申请滚动递交,预计将于2023Q1完成。如果获批,CTX001将成为首款获批的CRISPR基因编辑疗法。
02
木头姐:基因编辑技术疗法已接近商业化落地
近日,木头姐(Cathie Wood)的方舟投资公司(ARK)发布了一年一度的《Big Ideas 2023》投研报告,在对全球最新创新技术趋势的展望中,提到了精准医疗和分子诊断两个话题。其中阐述了关于基因编辑技术的商业化落地应用以及其未来发展前景的看好。
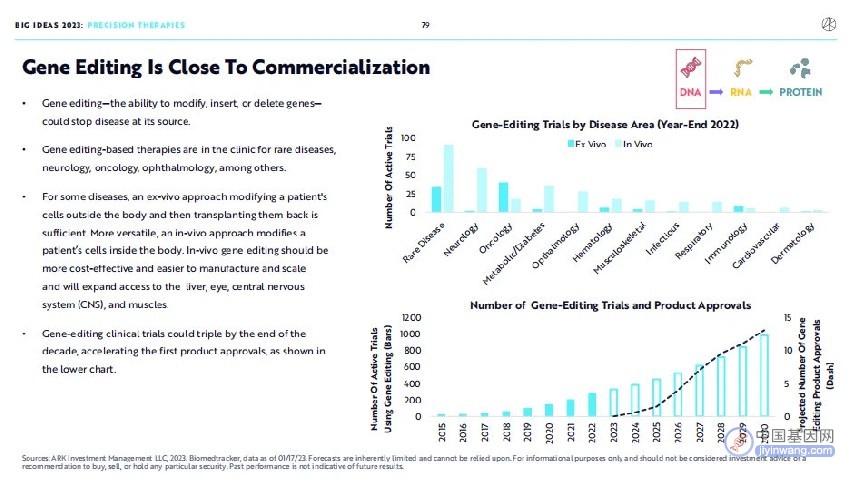
报告指出,基因编辑技术使得修改、插入和删除基因成为可能,这将从源头上治疗疾病。使用基因编辑技术的治疗方法将遍布罕见病、神经疾病、癌症、眼科等多个疾病领域。
对于某些疾病,可以采用体外基因编辑的方法,将细胞在体外进行基因编辑再移植回体内。更通用的方法是进行体内基因编辑,体内基因编辑有更好的成本效益,并且更易于生产及扩大规模,并将使得基因编辑技术扩展应用到肝脏、眼睛、肌肉和中枢神经系统等多种器官。
到2030年,运用基因编辑技术的临床试验数量增加到现有的三倍之多,以及加速首个基因编辑药物的上市。
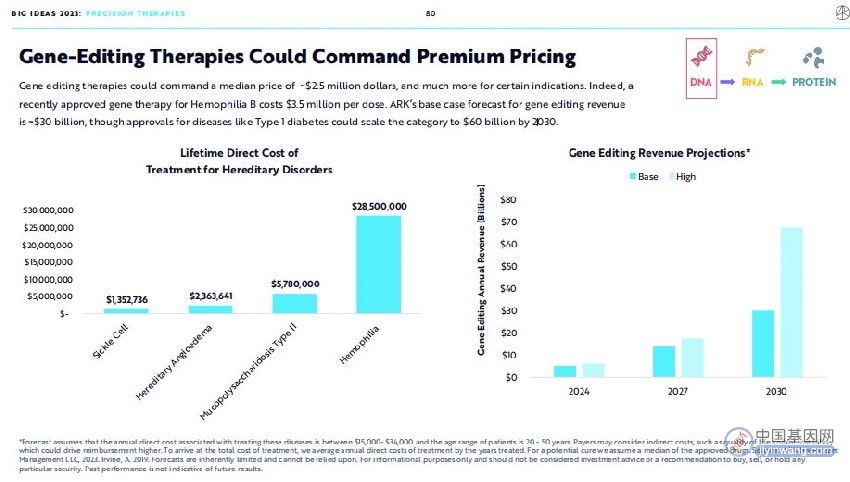
基因编辑疗法能够获得高溢价。基因编辑疗法定价的中位数可能达到250万美元,在某些特定的适应症领域将会更高。毕竟,一个近期获批上市的A型血友病基因疗法的费用高达350万美元。ARK Invest预测,到2030年基因编辑疗法年总收入将达到300亿美元,如果能够拓展应用于治疗1型糖尿病,年总收入将扩展至600亿美元。
03
结语
基因编辑是目前生物医学的最前沿技术之一,CRISPR技术在疾病治疗、基因功能调控、药物研发等多个方面具有广阔的应用前景,随着技术的不断完善,存在的“脱靶”问题逐步得到改善,特别是是在临床上的应用,将解决一些以前没有治疗药物的疾病或者一些基因缺陷型疾病,国内也有多家公司开始布局该领域的研发。
尽管基因编辑技术在未来的广泛应用具有非常大的潜力,但在安全性、可靠性和道德伦理方面仍需要科学实践论证和规范边界。
医药创新生态大会(CPIE)将于2023年4月23日-26日由中康科技与张江集团联合主办。
本届大会以“正向淘汰&创新求真——研发聚焦与商业转化的二元竞争”为主题,以“研发驱动·生态共建、新药普及·商业转化”为核心标签,汇聚国内外科研院所、创新药企、生物科技公司、投资机构、产业园区、CXO医药创新上下游企业、数字化营销服务方、政府与监管机构等1500+医药创新生态群体,助力生物医药行业的创新与发展,致力于打造成为中国医药创新领域顶尖的生态盛会。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。







![基因测序行业深度研究报告:未来大健康领域黄金赛道[共77页] 基因测序行业深度研究报告:未来大健康领域黄金赛道[共77页]](/static/upload/other/20230126/1674744324488315.jpeg)