胎盘是一个了不起的器官,胎儿会利用爸爸的“贪婪”基因遥控妈妈!
科学家找到了胎儿依靠父系印记基因控制母亲,将营养转移到自身的直接证据。

对于哺乳动物来说,母亲与胎儿之间的关系既有合作也存在冲突。近日,英国剑桥大学领导的一项研究发现,胎儿能够利用从父亲那里继承的基因,“遥控”母亲在怀孕期间为自己提供尽可能多的营养。
这项 7 月 11 日发表于《细胞-代谢》(Cell Metabolism)的新研究,为我们提供了胎儿依靠父系印记基因控制母亲,将营养转移到自身的直接证据,凸显了妊娠期母子营养分配的重要性。
“贪婪”的父系基因
在营养分配这个层面,怀胎十月的过程可以称得上是一场“拉锯战”。在这场角力中,母亲的身体固然希望胎儿能够存活下来,但是为了自身的健康,母亲需要将足够多的葡萄糖和脂肪保留在自己体内,为后续的分娩、母乳喂养,以及更多的受孕做准备。
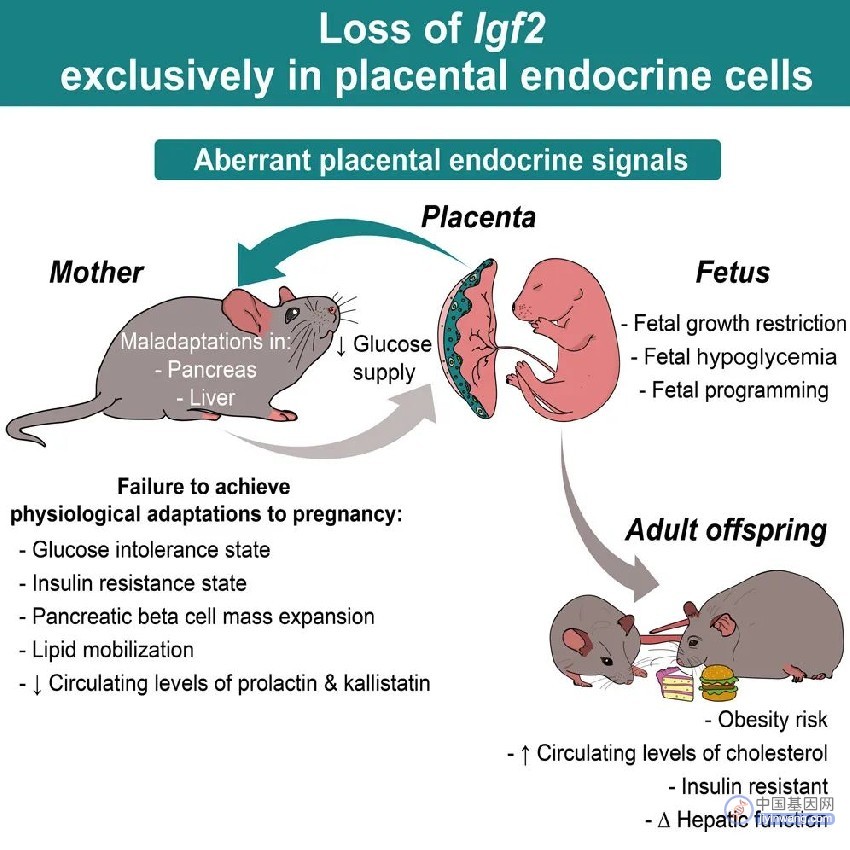
胎儿则演化出了多种方法来“操纵”母亲的生理过程,加强母亲体内的营养向胎盘转移。在这项新研究中,学者们发现,一个父源性印记基因 Igf2 在帮助胎儿“占领”营养资源的过程中发挥了重要作用。
印记基因是一对带有“不平等”标记的等位基因。在父母双方的配子结合成受精卵后,这种“不平等”标记(例如表观遗传学修饰)仅允许来自一方亲本的基因表达,来自另一方亲本的则被沉默。在胎儿发育中,印记基因的这种特性至关重要。研究的共同通讯作者、剑桥大学惠康-MRC 代谢健康研究所(Wellcome-MRC Institute of Metabolic Science)研究员 Miguel Constancia 表示:“父系基因是‘贪婪’且‘自私’的,它们倾向于控制母体资源帮助胎儿长得又大又健康。”相对的,母系基因则倾向于控制胎儿生长,防止孩子太大而难以分娩。
Igf2 就是这样一个来自父亲的“贪婪”基因。该基因高度保守,编码一种名为胰岛素样生长因子(Insulin-like growth factor 2,IGF2)的激素样肽。IGF2 是一种重要的生长因子,能够促进胎儿的生长,并帮助胎盘以及胎儿肝脏和大脑正常发育。在这项研究中,研究人员想要知道,如果胎盘细胞中的父源性 Igf2 基因功能被关闭,是否会令母亲无法为胎儿提供足够的葡萄糖和脂肪等营养物质,导致胎儿难以正常生长。
遥控开关
这一推论得到了小鼠实验的证实。在怀孕小鼠的子宫中,胎盘是连接母体和胎儿的“生命通道”,它不仅能为胎儿提供营养、排出代谢废物,还会产生和分泌多种激素和生长因子,调节母体代谢和胎儿生长发育。研究者敲除了胎盘内分泌细胞中高度表达的父源性 Igf2 基因,发现这虽然不会影响胎盘形态,但导致胎儿平均体重减少了 9%,血糖水平较对照组降低了 33%,出现了生长受限与低血糖问题。
图片来源:论文
Igf2 基因的敲除不仅会损害胎儿的营养代谢,还会“隔空”影响母体。为了将足够的葡萄糖输送给胎儿,自然妊娠发生后,母亲体内会发生短暂的胰岛素抵抗,这意味着母体细胞对胰岛素的响应能力降低,葡萄糖更不容易被母体细胞吸收代谢。然而,敲除胎盘内分泌细胞的 Igf2 基因后,怀孕的小鼠母体不再发生胰岛素抵抗,母体细胞对胰岛素的敏感性得到保留,与那些没有妊娠的雌性小鼠水平一致。进一步的研究发现,这可能是通过调节母体肝脏细胞内 mTORC1 信号通路的活性实现的。
研究的共同通讯作者、剑桥大学教授 Amanda Sferruzzi-Perri 表示,Igf2 控制着能够降低妊娠期母亲胰岛素敏感性的激素,它会令母亲的组织对葡萄糖的吸收减弱,因而循环系统中的营养物质更容易转移到胎儿体内。
如果胎儿存在 Igf2 基因缺陷,就可能出现过度生长或生长迟缓的情况。并且还会在成年后表现出肥胖、胰岛素抵抗、葡萄糖不耐受等代谢紊乱问题。
接下来,研究者们准备深入研究 Igf2 能够控制胎盘分泌的哪些激素,以及具体的控制方法。这可以帮助我们发现针对胎盘的治疗手段,改善母亲和胎儿的健康状态。
正如 Sferruzzi-Perri 所说,胎盘是一个了不起的器官,尽管它在胎儿出生后就不再与母子任何一方相连,但仍会以改变我们后代健康的方式留下终生影响。
论文信息:
Fetal manipulation of maternal metabolism is a critical function of the imprinted Igf2 gene. Lopez-Tello, Jorge et al. Cell Metabolism, Volume 35, Issue 7, 1195 - 1208.e6
https://doi.org/10.1016/j.cmet.2023.06.007
主要参考资料:
https://www.eurekalert.org/news-releases/994920
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。