Cancer Cell:癌症全基因组甲基化研究
人类癌症表观基因组学很大程度上被重新制定,包括基因启动子区CpG岛的超甲基化和全基因组水平的低甲基化。CpG岛甲基化与染色质重塑及基因表达的关系已被广泛研究。H3K4组蛋白甲基化转移酶(HMTs)对基因表达调控的方式多样化。该家族包括6种主要成员,从KMT2A 到 KMT2G。H3K4me3已报道与活化基因启动子区未甲基化CpG岛的修饰及维持相关,DNA甲基化转移酶DNMT3A/L未与H3K4me2/3结合,但与H3K4me0有高结合,与H3K4me1的结合降低了2倍(Noh et al., 2015; Ooi et al,2007)。因此这可能会引起H3K4单甲基化在调节调控元件DNA甲基化模式中发挥作用。
DNA HYPERMETHYLATION ENCROACHMENT AT CPG ISLAND BORDERS IN CANCER IS PREDISPOSED BY H3K4 MONOMETHYLATION PATTERNS
H3K4单甲基化模式预示着癌症中CPG岛边界的DNA超甲基化堆积
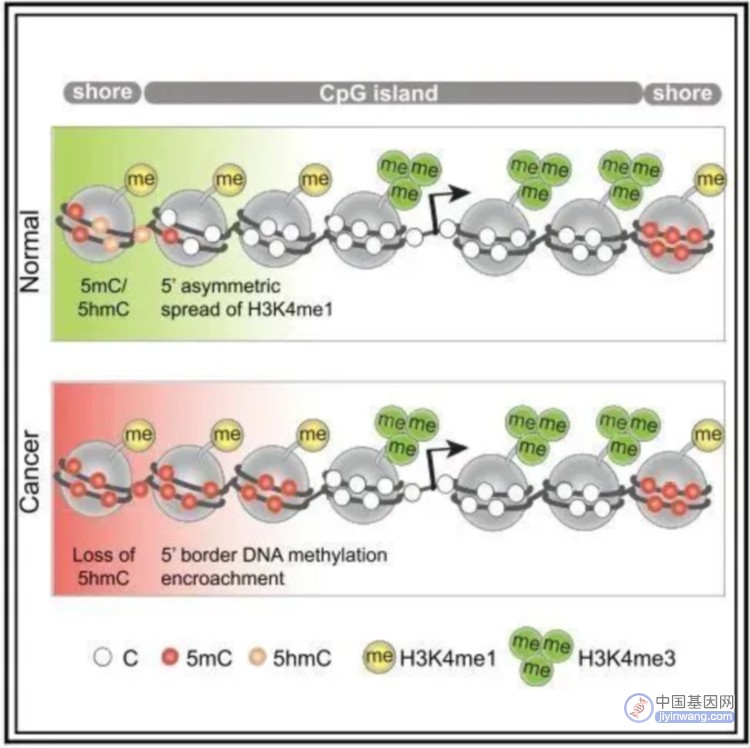
正常细胞中启动子区CpG岛通常是低甲基化的,但在肿瘤细胞中,多为超甲基化。采用甲基化测序技术,作者鉴定了5’或3’CpG岛边界的部分甲基化堆积。其在前列腺癌和乳腺癌广泛分布,与基因抑制相关。正常细胞中,在CpG岛边界H3K4me1模式预测癌症CpG岛高甲基化的不同模式。值得注意的是,Kmt2d的基因操纵导致H3K4me1水平和CpG岛边界DNA甲基化堆积的共同变化。文章研究结果表明H3K4me1在正常细胞中的CpG岛甲基化边界的划分中起作用,其在癌症中被堆积。
样本5mC和5hmC检测
文章结果发现在5’或3’不对称甲基化的CpG岛边界,正常细胞中具有高甲基化,但广泛甲基化的或双向甲基化堆积的CpG岛在island shores具有高甲基化水平。正常组织中5hmC对DNA去甲基化及未甲基化CpG岛的保护具有重要作用。此外癌组织中5hmC大范围的减少可能会参与CpG岛的超甲基化。文章采用3对前列腺癌样本进行5hmC与5mC检测,正常组织中表现出增强的CpG岛shores 5hmC水平,且基因CpG岛DNA甲基化堆积伴随shores处5hmC的降低。
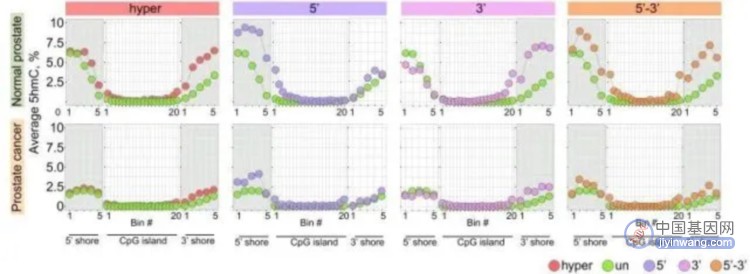
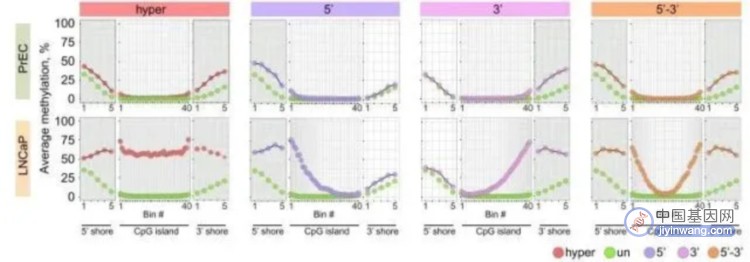
H3K4me1 在CpG岛边界的作用
采用chip-seq数据,分析H3K4me1在癌症CpG岛超甲基化中的富集方式。H3K4me1高富集于hESCs CpG岛的body区,在癌症中呈现广泛超甲基化。相反,癌症中未甲基化的CpG岛,在hESCs中表现为边界双峰富集及岛区域降低。并且,文章发现一种hESCs中不对称的H3K4me1富集模式,在对应5’或3’内CpG岛边界,易于癌症中DNA甲基化。通过可视化图展现了候选的CpG岛,显示癌症中5’和3’的甲基化堆积,可以由正常前列腺细胞中H3K4me1预先标记。
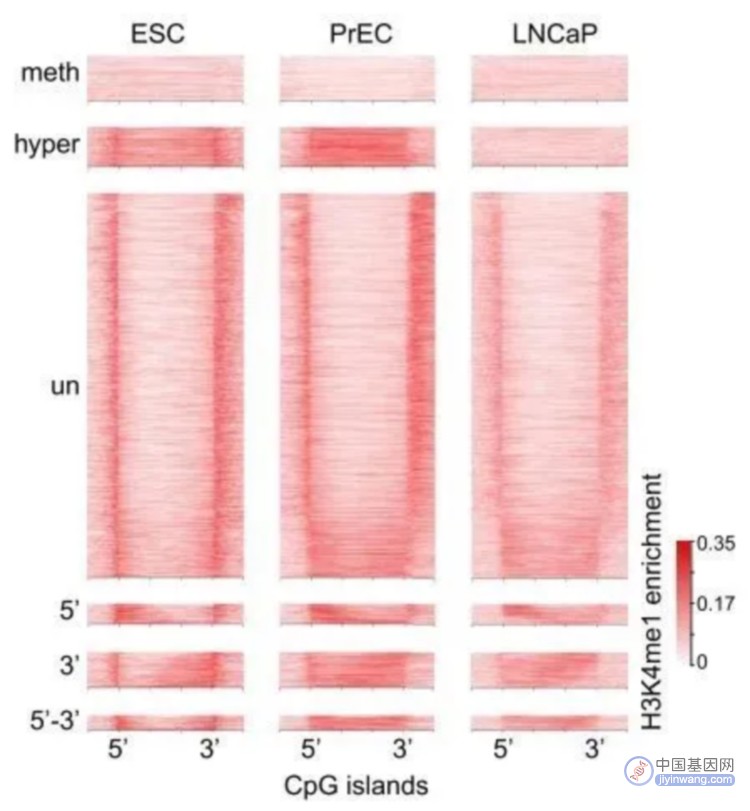
小结:
· 癌症中,启动子区CpG岛展现出不对称的边界甲基化;
· 正常细胞中,5hmC富集在CpG island shores易于甲基化扩散;
· CpG岛边界的H3K4me1模式与其甲基化模式关联;
· H3K4me1的破坏导致边界DNA甲基化的改变。
参考文献:
Skvortsova K, Masle-Farquhar E, et al.DNA Hypermethylation Encroachment at CpG Island Borders in Cancer Is Predisposed by H3K4 Monomethylation Patterns.Cancer Cell,2019.
ONT测序是独一无二的基于电信号识别碱基序列的三代测序技术,可直接读取甲基化修饰信息5mC、5hmC、6mA等,无需经过重硫酸盐处理或者抗体免疫沉淀富集,可绘制单碱基分辨率的DNA甲基化图谱。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。