癌细胞基因组中的“不易丢失”突变可驱动持续的抗肿瘤免疫反应
肿瘤突变负荷(TMB)可以在一定程度上反映抗肿瘤免疫反应强度,理论上TMB越高,能别免疫系统识别的新抗原(neoantigens)就越多,抗肿瘤免疫疗效就越好,但TMB并不能始终如一地预测癌症免疫疗法的临床效用。之前的工作已经指出杂合突变可以通过染色体缺失和杂合性缺失(LOH)选择性消除,从而赋予对免疫检查点阻断(ICB)的获得性抗性,而基因组区域中包含的突变和相关新抗原在每个癌细胞的单个拷贝中存在,在治疗的选择性压力下不太可能被染色体丢失消除,因此可能介导持续的新抗原驱动的免疫反应和长期临床获益【1, 2】。
近日,来自约翰霍普金斯大学医学院的Valsamo Anagnostou团队在Nature Medicine杂志上发表了一篇题为Persistent mutation burden drives sustained anti-tumor immune responses的文章,他们对31种肿瘤类型(n=9242)和8组接受ICB的非小细胞肺癌、黑色素瘤、间皮瘤和头颈癌患者(n=524)进行泛癌分析,发现单拷贝区域中的突变和存在多个拷贝的突变共同构成了持续性肿瘤突变负荷(pTMB),在免疫疗法的选择性压力下,肿瘤进化保留了持续性突变,且具有高pTMB含量的肿瘤具有炎症反应更强的肿瘤微环境,因而可能推动抗肿瘤免疫反应。

研究人员首先对TCGA中31种肿瘤类型的拷贝数图谱分析,发现单倍体区域拷贝数的丢失率始终低于整倍体区域的丢失率,且单拷贝和多拷贝状态下序列改变的整合揭示了突变的癌症类型依赖性分布,TMB相似的肿瘤类型在多拷贝和单拷贝含量上也存在差异,因而作者提出一种不同于TMB的突变测定并称之为持续性TMB(pTMB),其中,多拷贝和单拷贝突变成分对整个pTMB的相对贡献因癌症谱系而异。后续作者也通过对8名接受ICB的患者治疗前和获得性耐药时数据的分析确认了pTMB不易在癌细胞后代中丢失。作者进一步在7个已发表的ICB队列和一组接受ICB的头颈部鳞状细胞癌(HNSCC)患者中探究pTMB和TMB的联系,与TCGA分析类似,在这些队列中未观察到两者的显著相关性,基于此可以认为pTMB和TMB是两种不同的指标,或许可以根据pTMB含量以癌症类型依赖的方式评估对ICB的治疗反应。
为此,作者评估pTMB与TCGA中肿瘤患者临床结果的相关性,发现pTMB与临床结果之间的关联是依赖于癌症谱系的,例如肺鳞状细胞癌、黑色素瘤和子宫癌肉瘤的pTMB与延长的总生存期显著相关,而TMB的与这三组的生存率相关性就较弱。此外,作者还评估了pTMB、多拷贝和单拷贝突变在预测524名黑色素瘤、非小细胞肺癌、间皮瘤和HNSCC患者ICB反应方面的潜力,发现其中具有高pTMB的肿瘤通过ICB可以获得更高的治疗反应率,而单独使用TMB的易丢失突变(占TMB的大多数)数量不能很好地区分有反应或无反应肿瘤。为了进一步确认pTMB在预测治疗反应上的优势,作者评估了具有差异pTMB/TMB的肿瘤,比较pTMB-low/TMB-high和pTMB-high/TMB-low肿瘤之间的治疗反应率,与pTMB- low /TMB-high组相比,pTMB-high/TMB- low类别中的肿瘤响应频率更高(前者8名反应者、15名无反应者;后者16名反应者,7名无反应者),这些发现共同支持pTMB在预测治疗反应方面的临床效用。
为什么高pTMB患者的ICB反应良好呢?作者探索了经ICB治疗的肿瘤中转录组情况,并假设高pTMB会产生不间断的新抗原供给,进而触发IFN-γ信号传导和可以通过ICB进一步增强适应性免疫级联反应。RNA-seq结果显示治疗前IFN-γ和炎症反应相关基因的显着富集,且在ICB治疗高pTMB肿瘤期间显著增强,但在按TMB分层的肿瘤中促炎基因组的差异富集减少,在比较由pTMB分层的TCGA组中黑色素瘤的TME的转录组学分析中观察到类似的趋势。此外,作者还观察到在基线和ICB治疗肿瘤中,pTMB与CD8+和CD4+ T细胞丰度以及M1与M2巨噬细胞之比呈正相关。
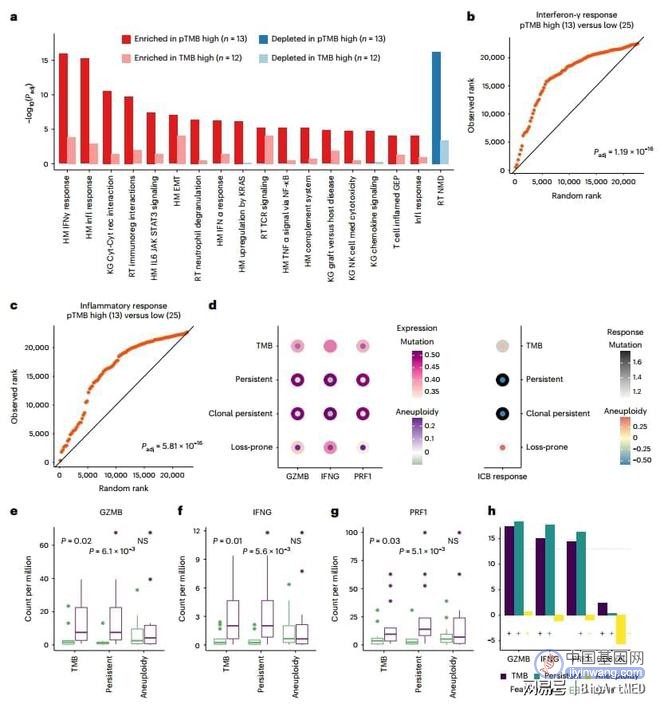
图1. 在ICB治疗的黑素瘤中,pTMB与炎症反应较强的TME相关。
总的来说,这项研究证明位于癌细胞基因组中单拷贝区域或多拷贝区域的突变不太可能在免疫治疗的选择性压力下丢失,因此可以作为持续性抗肿瘤免疫治疗的关键驱动力。
https://doi.org/10.1038/s41591-022-02163-w
参考文献
1. Anagnostou, V. et al. Evolution of neoantigen landscape during immune checkpoint blockade in non-small cell lung cancer.Cancer Discov.7, 264–276 (2017).
2. Forde, P. M. et al. Durvalumab with platinum-pemetrexed for unresectable pleural mesothelioma: survival, genomic and immunologic analyses from the phase 2 PrE0505 trial.Nat. Med.27, 1910–1920 (2021).
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。