肺癌联合疗法77%疾病控制率、多款基因/RNA疗法步入临床…
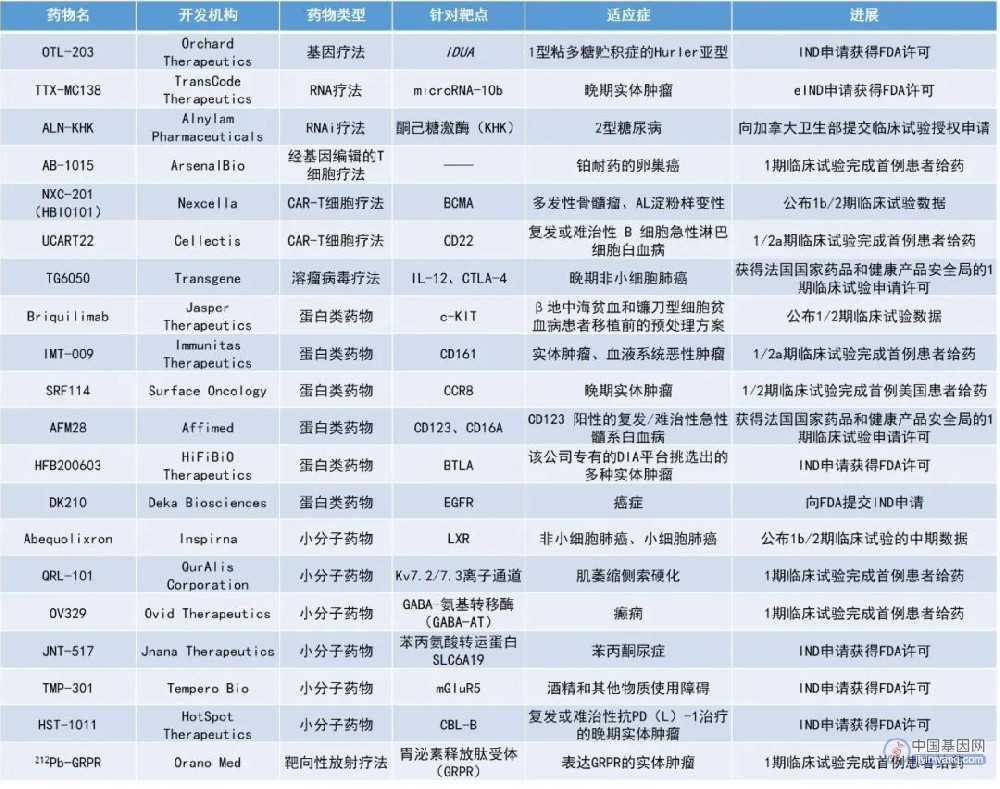
1. 潜在“first-in-class”的肝脏X受体(LXR)小分子激动剂abequolixron在不同类型肺癌中的早期临床试验结果公布,联用化疗的总缓解率(ORR)达38%,疾病控制率(DCR)达77%。
2. 早期概念验证研究中2年总生存率达100%,患儿发育趋势与健康儿童相当,罕见病基因疗法的IND申请获得FDA许可。
3. II/III期转移性三阴乳腺癌小鼠模型中实现100%的预先存在的转移病灶消除率,针对多种实体瘤的创新RNA疗法获FDA授权,开启首个人体0期临床试验。
4. 针对难以成药靶点,创新别构抑制剂JNT-517的IND申请获得FDA许可,用于治疗任何年龄和基因型的苯丙酮尿症(PKU)患者。
Abequolixron:公布1b/2期临床试验的中期数据

Inspirna公司公布了其潜在“first-in-class”的口服LXR小分子激动剂abequolixron在非小细胞肺癌(NSCLC)和小细胞肺癌(SCLC)患者中的1b/2期临床试验的中期数据。该候选疗法旨在激活肿瘤抑制蛋白APOE的表达来抑制肿瘤血管生成、消耗髓源性抑制细胞(MDSC)和激活细胞毒性T淋巴细胞(CTL),并增强抗肿瘤免疫反应。
此次公布的数据表明,abequolixron与全剂量多西紫杉醇联合使用具有良好的耐受性,同时显示出令人鼓舞的临床活性,表明该候选药物有望作为曾接受大量前期之类患者在标准治疗之外的附加疗法。所有可评估患者的ORR为38%(n=13),DCR为77%,包括5例达到部分缓解(PR)的患者。在2/3线NSCLC队列中,5例可评估的患者中,有4例患者实现了PR,2例患者获得了确认的PR。在2线SCLC队列中,8例可评估的患者中,有1例患者实现了PR,5例患者的最佳总体缓解情况为稳定疾病(SD)。四例患者在24周的服药期间内未发生进展。最常见的治疗伴发不良反应(TEAE)为疲劳(12例)、腹泻和恶心(9例)、食欲下降(8例),以及中性粒细胞减少和体重减轻(7例)。其中,2例患者发生了4级中性粒细胞减少。
OTL-203:IND申请获得FDA许可

OTL-203是一种造血干细胞(HSC)基因疗法,正在被开发用于治疗1型粘多糖贮积症(MPS-I)的Hurler亚型。MPS-I是一种罕见且致命的儿童遗传病,会影响身体产生α-L-艾杜糖苷酸酶(IDUA,一种有助于分解细胞内长链糖的必需酶)的能力。无法完全降解的糖链积聚在细胞中会造成渐进性的损伤。大约有60%的MPS-I出生儿童患有的是最严重的Hurler亚型(MPS-IH),未经治疗的患儿很少能活过10岁。OTL-203利用修饰的病毒可以将IDUA基因在体外插入患者自身的造血干细胞中,然后再回输到患者体内,以纠正该疾病的根本原因。
在较早的一项单中心概念验证研究中,8例MPS-IH患者在2018年7月至2019年12月期间接受了研究性OTL-203的治疗。结果显示,所有患者在治疗后都获得了稳定的认知发育,且身体上的发育也符合同年龄段和性别的健康儿童的生长趋势。中位随访时间为2年时,患者的总生存率为100%。此外,OTL-203的耐受性良好,未发现由于基因插入导致的癌症,也没有证据表明该基因由于整合到癌基因中而具有克隆优势。此前,OTL-203已分别获得FDA和欧洲药品管理局授予的的罕见儿科疾病认定和PRIME资格。
TTX-MC138:eIND申请获得FDA许可

TransCode Therapeutics公司宣布,其主要治疗候选药物TTX-MC138获FDA书面授权,可进行首次人体0期临床试验。该临床试验将在12例晚期实体肿瘤患者中开展。TTX-MC138旨在抑制促转移RNA——microRNA-10b,它被认为是多种晚期实体瘤转移的主要调节因子。
在临床前研究中,TTX-MC138展现出对多种癌症模型的有效性,包括乳腺癌、胰腺癌、卵巢癌、结肠癌、胶质母细胞瘤等等。在II/III期转移性三阴乳腺癌小鼠模型中,使用低剂量化疗和TTX-MC138联合疗法消除了100%预先存在的局部转移病灶。在更具侵袭性的IV期癌症小鼠模型中,低剂量化疗和TTX-MC138治疗消除了65%治疗动物的远处转移。在胰腺癌小鼠模型中,TTX-MC138作为单一疗法使40%治疗动物达到了CR,肿瘤消退且无复发。
JNT-517:IND申请获得FDA许可
Jnana Therapeutics的先导候选化合物JNT-517是一种潜在的“first-in-class"口服小分子抑制剂,靶向苯丙氨酸转运体SLC6A19上的别构位点,用于治疗PKU。PKU由苯丙氨酸羟化酶(PAH)缺乏引起。苯丙氨酸是存在于所有含蛋白质食物中的一种氨基酸,而PAH是分解苯丙氨酸所必需的酶。当PAH缺乏或功能缺陷时,苯丙氨酸将在血液中积累至异常高的毒性水平。如果不及时治疗可能导致进行性和严重的神经功能损伤和神经心理并发症。SLC6A19是一种转运蛋白,负责肾脏对苯丙氨酸的重吸收至血液中。JNT-517通过抑制SLC6A19来阻止阻止肾脏对苯丙氨酸的重吸收,提供了一种潜在疗法来降低血液苯丙氨酸水平。JNT-517为可用于治疗任何PKU患者的潜在“first-in-class”口服疗法,无论其年龄或基因型如何。此前,该候选疗法已获得了FDA授予的罕见儿科疾病认定。
NXC-201(HBI0101):公布1b/2期临床试验数据
Nexcella公司公布了其靶向BCMA的CAR-T细胞疗法NXC-201在1b/2期开放标签试验中的结果。研究结果显示,在治疗剂量下,对中位治疗线数为6线(范围,3-13)的复发/难治性多发性骨髓瘤患者,ORR达85%,完全缓解/严格意义的完全缓解(CR/sCR)率为71%。此外,NXC-201还在4例复发/难治性AL淀粉样变性患者中产生了100%的ORR和100%的器官缓解率。安全性方面,在NXC-201的治疗中未观察到任何等级的神经毒性。
TG6050:获得法国国家药品和健康产品安全局的1期临床试验申请许可
TG6050是由Transgene公司利用其专有的Invir.IO平台生成的溶瘤病毒疗法,该候选疗法通过选择性靶向肿瘤细胞,并能在肿瘤微环境中表达IL-12和抗CTLA-4抗体,进而引发强大且多管齐下的抗肿瘤反应。TG6050通过静脉注射给药,与现有唯一获批的瘤内注射的给药途径相比,可使更多患有无法进行瘤内注射的癌症患者也有机会从溶瘤病毒疗法中获益。即将开展的1期临床试验将招募36例标准治疗(包括免疫检查点抑制剂)失败的晚期NSCLC患者。TG6050有望通过多种作用机制启动抗肿瘤反应来克服肿瘤的耐药性。
Briquilimab:公布1/2期临床试验数据
Jasper Therapeutics公布了在β地中海贫血(TDT)和镰刀型细胞贫血病(SCD)患者的现有骨髓移植方案中,加入其c-KIT单克隆抗体briquilimab作为移植前预处理方案的1/2期临床试验的积极结果。结果显示,所有接受briquilimab治疗的SCD患者(3例)均在12-16天内成功完成移植。完成同种异体干细胞移植后60天时,前两例外周血嵌合的受试者实现了100%的供体骨髓嵌合。第一个接受治疗的受试者在随访至5个月时,总血红蛋白的水平为从基线时的8-9 g/dL增加到了13.3 g/dL。
AFM28:获得法国国家药品和健康产品安全局的1期临床试验申请授权
AFM28是一种通过Affimed公司的重定向优化细胞杀伤(ROCK)平台开发的四价双特异性先天细胞衔接蛋白(innate cell engager, ICE),能够结合CD123和CD16A。该候选疗法旨在利用自然杀伤(NK)细胞通过抗体依赖性细胞毒性(ADCC)来启动肿瘤细胞杀伤,为患有CD123阳性(甚至CD123低表达)髓系恶性肿瘤病患,例如急性髓系白血病(AML)和骨髓增生异常综合征(MDS),带来一种新的免疫治疗方法。临床开发计划将AFM28作为单一疗法或与同种异体NK细胞联合使用,以治疗CD123阳性的复发/难治性白血病患者。
HFB200603:IND申请获得FDA许可
HFB200603是HiFiBiO Therapeutics公司开发的一种靶向免疫检查点BTLA的新型单克隆抗体,可阻断与其配体HVEM的相互作用。HFB200603旨在逆转HVEM介导的免疫抑制作用,并诱导HiFiBiO专有药物智能科学(DIS)平台挑选出的各种实体瘤的肿瘤微环境中炎症性细胞因子的产生。此外,HFB200603与PD-1抑制剂能发挥出协同作用,并显示出良好的可开发性、药代动力学和安全性。
TMP-301:IND申请获得FDA许可
TMP-301是一种有效的口服代谢性谷氨酸受体5(mGluR5)负别构调节剂(NAM),可抑制(但不能阻断)与药物滥用相关的特定大脑区域的谷氨酸信号传导。该候选疗法具有称为治疗物质使用障碍的新型疗法的潜力,包括可卡因使用障碍(CUD)和酒精使用障碍(AUD)、阿片类药物使用障碍(OUD)和多物质使用障碍(PUD)等。其中,针对CUD和AUD的研究已进入1期临床。
HST-1011:IND申请获得FDA许可
HST-1011是由HotSpot专有的Smart Allostery平台所设计的一种选择性小分子CBL-别构抑制剂。CBL-B是一种参与免疫细胞反应的关键E3泛素蛋白连接酶。作为效应细胞(T细胞和自然杀伤细胞)免疫的主调节因子,CBL-B的失活能够消除其内源性的负向调节功能,从而显著增强抗肿瘤免疫反应。HST-1011的设计具有紧密结合、低纳摩尔效力,以及与靶标的解离速率缓慢的特点,可实现持续的药理学作用,并且相对于C-CBL,它对CBL-B具有更高的选择性。临床前数据表明,HST-1011能够结合和抑制CBL-B上的天然热点,从而激活和扩大靶向抗肿瘤免疫反应。
参考资料:
[1] Cellectis Announces First Dosing of a Patient with its In-house Manufactured Product Candidate UCART22 for the treatment of r/r B-cell ALL. Retrieved January 6, 2023, from https://cellectis.com/en/press/cellectis-announces-first-dosing-of-a-patient-with-its-in-house-manufactured-product-candidate-ucart22-for-the-treatment-of-r-r-b-cell-all/
[2] AFFIMED ANNOUNCES APPROVAL OF CLINICAL TRIAL APPLICATION IN FRANCE FOR A PHASE 1 STUDY OF AFM28 IN RELAPSED/ REFRACTORY ACUTE MYELOID LEUKEMIA. Retrieved January 6, 2023, from https://www.affimed.com/affimed-announces-approval-of-clinical-trial-application-in-france-for-a-phase-1-study-of-afm28-in-relapsed-refractory-acute-myeloid-leukemia/
[3] Alnylam Submits CTA Application for ALN-KHK, an Investigational RNAi Therapeutic for the Treatment of Type 2 Diabetes. Retrieved January 6, 2023, from https://www.businesswire.com/news/home/20221221005114/en/
[4] Nexcella, Inc., a subsidiary of Immix Biopharma, announces poster presentation at the European Society for Blood and Marrow Transplantation and European Hematology Association 5th Annual European CAR T-cell Meeting. Retrieved January 6, 2023, from https://www.globenewswire.com/news-release/2022/12/28/2580180/0/en/Nexcella-Inc-a-subsidiary-of-Immix-Biopharma-announces-poster-presentation-at-the-European-Society-for-Blood-and-Marrow-Transplantation-and-European-Hematology-Association-5th-Annu.html
[5] Deka Biosciences, Inc Announces Submission of Investigational New Drug (IND) Application for Lead Oncology Asset, DK210 (EGFR). Retrieved January 6, 2023, from https://www.prnewswire.com/news-releases/deka-biosciences-inc-announces-submission-of-investigational-new-drug-ind-application-for-lead-oncology-asset-dk210-egfr-301710089.html
[6] TransCode Therapeutics Announces FDA Authorization to Proceed with First-In-Human Clinical Trial. Retrieved January 6, 2023, from https://www.globenewswire.com/news-release/2022/12/29/2580658/0/en/TransCode-Therapeutics-Announces-FDA-Authorization-to-Proceed-with-First-In-Human-Clinical-Trial.html
[7] Jasper Therapeutics Announces Positive Clinical Data from a Phase I/II Trial of Briquilimab as a Conditioning Treatment in Sickle Cell Disease and Beta Thalassemia. Retrieved January 6, 2023, from https://www.globenewswire.com/news-release/2023/01/03/2582114/0/en/Jasper-Therapeutics-Announces-Positive-Clinical-Data-from-a-Phase-I-II-Trial-of-Briquilimab-as-a-Conditioning-Treatment-in-Sickle-Cell-Disease-and-Beta-Thalassemia.html
[8] Tempero Bio Announces FDA Clearance of Investigational New Drug (IND) Application for TMP-301 for the Treatment of Alcohol and Other Substance Use Disorders. Retrieved January 6, 2023, from https://www.temperobio.com/news2023-jan04
[9] Immunitas Therapeutics Announces First Patient Dosed in Phase 1/2a Study of IMT-009. Retrieved January 6, 2023, from https://www.prnewswire.com/news-releases/immunitas-therapeutics-announces-first-patient-dosed-in-phase-12a-study-of-imt-009-301712686.html
[10] HotSpot Therapeutics Announces FDA Clearance of IND Application for HST-1011, An Investigational Small Molecule Allosteric Inhibitor of CBL-B. Retrieved January 6, 2023, from https://www.prnewswire.com/news-releases/hotspot-therapeutics-announces-fda-clearance-of-ind-application-for-hst-1011-an-investigational-small-molecule-allosteric-inhibitor-of-cbl-b-301712062.html
[11] Orano Med Starts Phase I Trial With Alpha Radioligand Therapy 212Pb-GRPR in Patients With Solid Tumors. Retrieved January 6, 2023, from https://www.businesswire.com/news/home/20230103005608/en/
[12] Inspirna Announces Interim Data from Phase 1b/2 Study of Abequolixron (RGX-104) in Relapsed or Refractory Lung Cancer. Retrieved January 6, 2023, from https://www.businesswire.com/news/home/20230105005235/en
[13] Orchard Therapeutics Announces U.S. FDA Clearance of IND Application for OTL-203 in MPS-IH. Retrieved January 6, 2023, from https://www.globenewswire.com/news-release/2023/01/05/2583531/0/en/Orchard-Therapeutics-Announces-U-S-FDA-Clearance-of-IND-Application-for-OTL-203-in-MPS-IH.html
[14] ArsenalBio Announces First Patient Dosed in Phase 1 Clinical Trial of AB-1015 in Development as a Treatment for Ovarian Cancer. Retrieved January 6, 2023, from https://www.businesswire.com/news/home/20230105005145/en/
[15] Surface Oncology Announces First Patient Dosed in a Phase 1/2 Study Evaluating SRF114, a Potential Best-In-Class Anti-CCR8 Antibody, in Patients with Advanced Solid Tumors. Retrieved January 6, 2023, from https://investors.surfaceoncology.com/news-releases/news-release-details/surface-oncology-announces-first-patient-dosed-phase-12-study
[16] QurAlis Announces First-in-Human Dose in Phase 1 Clinical Trial of QRL-101, a First-in-Class Kv7 Precision Therapy for ALS. Retrieved January 6, 2023, from https://quralis.com/quralis-announces-first-in-human-dose-in-phase-1-clinical-trial-of-qrl-101-a-first-in-class-kv7-precision-therapy-for-als/
[17] Ovid Therapeutics Dosed Healthy Volunteers with OV329 in Phase 1 Trial. Retrieved January 6, 2023, from https://investors.ovidrx.com/news/news-details/2023/Ovid-Therapeutics-Dosed-Healthy-Volunteers-with-OV329-in-Phase-1-Trial/default.aspx
[18] Jnana Therapeutics Announces FDA Clearance of IND Application for JNT-517 for the Treatment of Phenylketonuria. Retrieved January 7, 2023, from https://www.prnewswire.com/news-releases/jnana-therapeutics-announces-fda-clearance-of-ind-application-for-jnt-517-for-the-treatment-of-phenylketonuria-301714659.html
[19] HiFiBiO Therapeutics Receives FDA Clearance of IND Application for HFB200603. Retrieved January 7, 2023, from https://www.businesswire.com/news/home/20230106005407/en
[20] Transgene Receives Approval to Start a Phase I Trial of TG6050, a Novel IL-12-Armed Oncolytic Virus Given by Intravenous Administration. Retrieved January 7, 2023, from https://www.businesswire.com/news/home/20230105005742/en/
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。