基因组中的“病毒残留物”可能会加剧神经退行性疾病的发生

一项新的研究发现,自然存在于人类基因组中的病毒遗传残留物可能影响神经退行性疾病的发生。
德国神经退行性疾病研究中心
德国神经退行性疾病研究中心(German Center for Neurodegenerative Diseases,DZNE)的研究人员根据对细胞培养物的研究得出了这一结论。他们在《自然-通讯》(Nature Communications)杂志上发表了这项研究。在他们看来,这种“内源性逆转录病毒”(Endogenous retroviruses)可能会导致异常蛋白质聚集体(某些失智症的标志)在大脑中的传播。因此,这些病毒残留将成为治疗的潜在靶点。

研究于2023年8月18日发表在《Nature Communications》(最新影响因子:16.6)杂志上
一段时间以来,人们一直怀疑病毒感染与神经退行性疾病的发生和发展有关。DZNE 科学家的实验室研究现在提出了一种机制,虽然与病毒有关,但不需要外部病原体感染。根据这项研究,罪魁祸首将是自然存在于人类基因组中的“内源性逆转录病毒”。
“在进化过程中,许多病毒的基因在我们的 DNA 中积累。这些基因序列大多是突变的,通常是沉默的,” DZNE 研究小组负责人、波恩大学(University of Bonn)教授 Ina Vorberg 解释说,“然而,有证据表明内源性逆转录病毒在某些条件下被激活,并促发癌症和神经退行性疾病。事实上,在患者的血液或组织中发现了来自这种逆转录病毒的蛋白质或其它基因产物。”
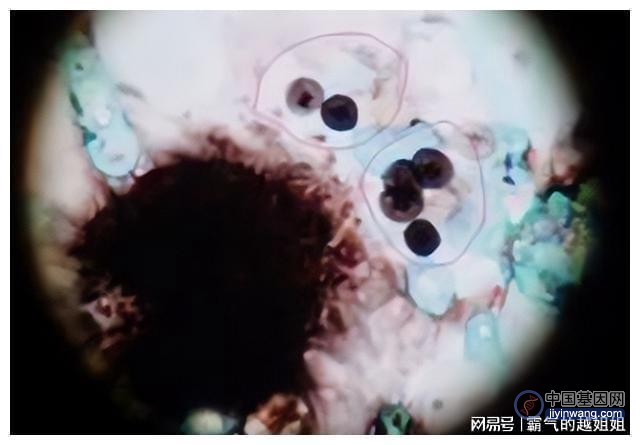
Tau蛋白聚集体的实验
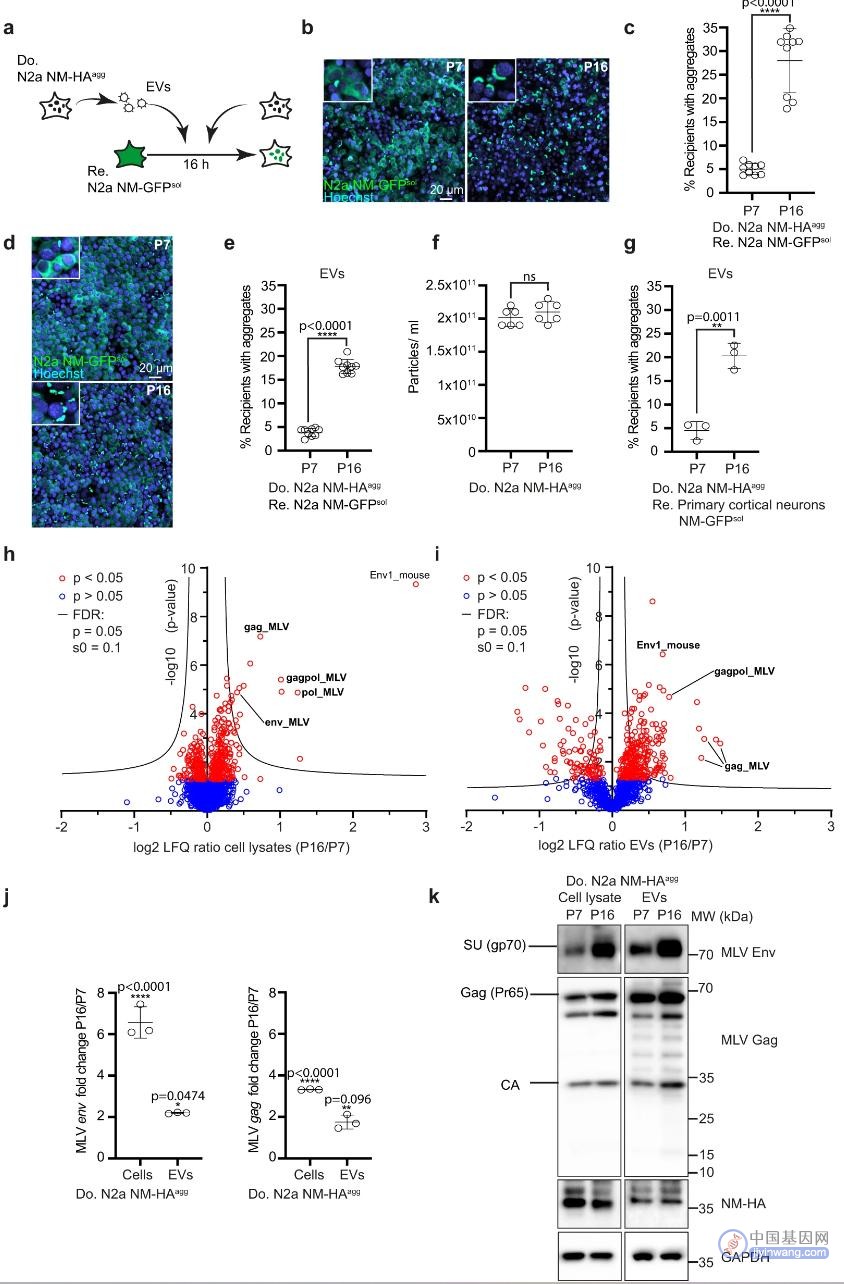
Vorberg 与来自波恩和慕尼黑的同事一起追踪了这一线索。利用细胞培养,研究人员模拟了人类细胞从内源性逆转录病毒的包膜产生某些蛋白质的情况。具体来说,这涉及 HERV-W 和 HERV-K,这两种病毒都存在于人类基因组中,但通常处于休眠状态。然而,研究表明 HERV-W 在多发性硬化中被激活,HERV-K 在神经系统疾病“肌萎缩侧索硬化”(ALS)和额颞叶失智(FTD)中被激活。
现在,Vorberg 的团队发现病毒蛋白促进所谓的 tau 蛋白聚集体从一个细胞到另一个细胞的运输。“Tau 蛋白聚集体”是发生在某些神经退行性疾病患者大脑中的微小蛋白质团块,这些疾病包括阿尔茨海默病和 FTD。“当然,大脑中的情况比我们的细胞模型系统所能复制的复杂得多。然而,我们的实验表明,内源性逆转录病毒可以影响细胞间 tau 蛋白聚集体的传播,” Vorberg 说,“因此内源性逆转录病毒将不是神经变性的触发因素,但一旦疾病进程已经开始,则可促进疾病进程。”
病毒转运介质
Vorberg 的团队目前的研究和早期的研究表明,病毒蛋白作为 tau 蛋白聚集体的运输介质,因为它们插入到细胞膜和所谓的细胞外囊泡的膜中,这些是细胞自然分泌的小脂肪泡。
“对于 tau 蛋白聚集体从细胞到细胞的运输,我们看到了两个特别的通路。在直接接触的细胞之间进行转移,在囊泡内进行运输,可以说,从一个细胞传递到另一个细胞,最终与它融合,” Vorberg 解释说,“在这两种情况下,膜必须融合。来自病毒包膜的蛋白质可以促进这一过程。这是因为许多病毒适应了与宿主细胞融合。这是通过病毒表面携带的特殊蛋白质来实现的。如果精确地将这些蛋白质并入细胞膜和细胞外囊泡的膜中,那么可以理解的是 tau 蛋白聚集体随后更容易扩散。”
治疗起点
在自然衰老过程中,基因的调控会发生变化,原本处于“休眠”状态的内源性逆转录病毒可能因此被“唤醒”。事实上,大多数神经退行性疾病的症状直到老年才表现出来。这就提出了两种可能的治疗方法。“一方面,人们可以尝试特异性地抑制基因表达,也就是说,使内源性逆转录病毒再次失活。这将触及问题的根源。但你也可以从其他地方开始,试图中和病毒蛋白,例如,用抗体。”
寻找抗体
在研究人员看来,有 tau 蛋白聚集体的失智症患者携带的此类抗体数量可能增加。如果能够利用生物技术方法分离并复制这些病毒,就有可能开发出被动疫苗。因此,Vorberg 的团队与 DZNE 在柏林和波恩的同事合作,旨在专门在患者中寻找这种抗体。此外,科学家们正在考虑抗病毒药物。在细胞培养中,他们已经发现这种制剂实际上可以阻止蛋白质聚集体的扩散。Vorberg 说:“这是我们打算采取的另一种方法。”


创立于2009年的德国神经退行性疾病研究中心
参考文献
Source:DZNE - German Center for Neurodegenerative Diseases
'Viral relicts' in the genome could fuel neurodegeneration
Reference:
Liu, S., Heumüller, SE., Hossinger, A. et al. Reactivated endogenous retroviruses promote protein aggregate spreading. Nat Commun 14, 5034 (2023). https://doi.org/10.1038/s41467-023-40632-z
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。