崩溃!超表达植株里的目的基因并没有被超表达?
好不容易通过图位克隆或生物信息学的方法得到了一个基因,乐颠乐颠地去构建了超表达载体,无比期待地去做了遗传转化,然鹅,用荧光定量PCR的技术检测之后,发现心心念念的基因竟没有被超...表...达?!排除了各种意外(用错了载体、用错了启动子、拿错了苗子、引物不够特异、不小心导出了师兄的定量数据)之后,不死心的再用Western Blot技术检测蛋白表达的情况,不敢相信,没有被超表达!这事,唔...确实...发生了...不论是在转录水平,还是在翻译水平...
这个场景有没有那么一点点熟悉,哈哈!也许这个问题一直困扰着你,但是没有关系,伯小远这次帮你查了不少的资料来解释这个诡异的结果,还附送了解决方法,所以,一定不要错过本篇呦!
共抑制现象
碰到这个问题,大家先莫慌莫慌哈,这个诡异的结果早在三十多年前就被研究者遇到了。
事情是这个样子的,自从第一株转基因植物问世以后,一旦遇到控制重要性状的基因(比如能让植物变得更抗病、更耐旱耐涝、果实更大更多的基因),研究者都想给它们做一做转基因,但有时也会事与愿违!
第一次遇见这个情况的研究者也很懵,他们将由强启动子启动的查尔酮合成酶(chalcone synthase,CHS)基因转入矮牵牛中,CHS与花色形成密切相关,本预期能加深花色,结果意外发现约有1/4的转基因株系开白紫相间的花(图1)或白色的花,随后研究者发现外源的CHS基因以及内源的CHS基因表达均发生了沉默(图2) (Napoli et al., 1990, van der Krol et al., 1990)。
超表达的基因发生了沉默,这种沉默与突变体引起的基因表达沉默不同,其外源基因已经整合至受体基因组中,并且整个T-DNA结构是完整存在的。

图1 在矮牵牛中超表达CHS基因的正义链和反义链,花色呈现出杂色 (Napoli et al., 1990, van der Krol et al., 1990)。CHS基因是合成花青素的关键酶。
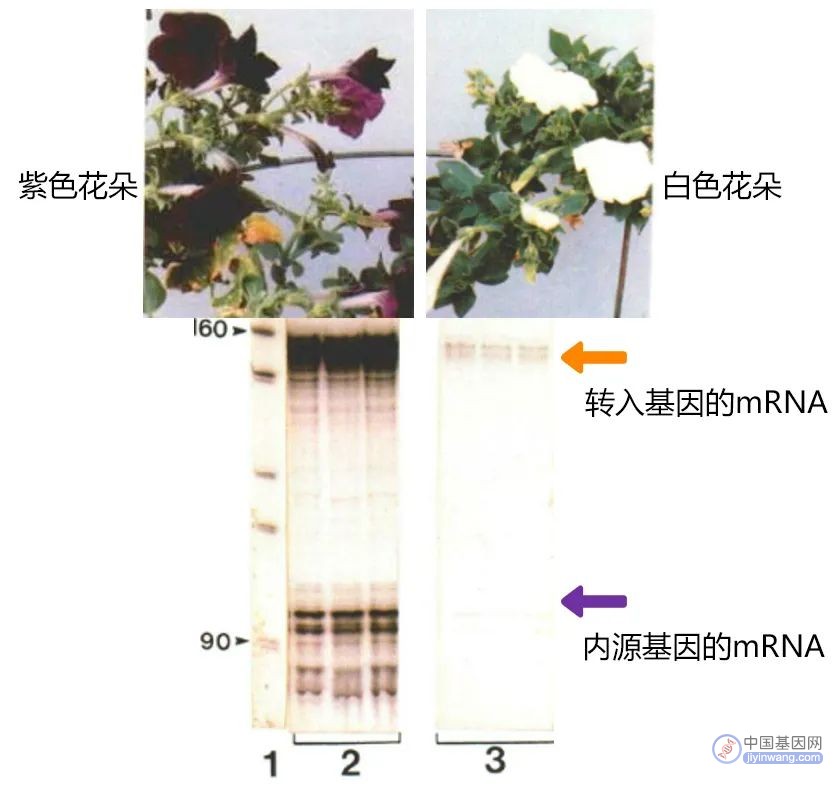
图2 检测超表达的CHS基因的mRNA以及内源CHS基因的mRNA (Napoli et al., 1990)。泳道2是转基因植株中产生紫色花朵植株的样品,泳道3是转基因植株中产生白色花朵植株的样品,结果显示白色花朵中的内源及外源CHS基因的转录受到严重抑制。
真是有趣的现象呢,那...原因是啥呢?
研究者研究后发现,基因沉默分为两种——位置效应引起的基因沉默和同源依赖(Homology-dependent)的基因沉默。
前者是由于外源基因插入特定的染色质部位所致,后者又可以分为两种,一种叫转录水平上的基因沉默(Transcriptional gene silencing,TGS),另一种叫转录后的基因沉默(Post transcriptional gene silencing,PTGS)。
TGS是由于DNA的修饰导致基因不能正常起始转录。
PTGS是基因虽然被转录了,但是相应的mRNA却积累很少或根本检测不到,不仅外源基因不表达,与其同源的内源基因也被抑制了,因此,PTGS也被称为共抑制(Co-suppression),这种现象在植物、动物、细菌及真菌中均存在。图1的杂色花就是因为转基因植株产生了共抑制。
当然,这些都是后话了。
当时,另一种有趣的现象也引起了研究者的注意。
植物抗病毒现象
植物抗病毒现象,是指在植物中表达病毒基因组片段的转基因植物可以通过某种干扰机制抵抗该种甚至相近病毒的侵染。
研究者最初是在烟草中发现的这个现象。将烟草蚀刻病毒(Tobacco etch virus,TEV)外壳蛋白基因转入烟草中,植株表现出典型的感病症状。3-5周后植株会从感染中恢复,新的茎、叶出现感病症状但经检测其中并不含病毒。恢复的植物组织表现出对TEV及相近病毒马铃薯Y病毒的抗性 (Lindbo et al., 1993)。
后来的故事我们也知道了,这种现象其实是由小RNAs(small RNAs,sRNAs)引起的。

图3 TEV感染转基因和野生型烟草后的表型 (Lindbo et al., 1993)。照片拍摄时间为感染TEV 5周后。1、2、3代表由老叶至新叶。结果显示,TEV感染野生型烟草Burley 49(左下)、感染转入了全长TEV外壳蛋白基因的植株(左上),其中,后者长出的新叶片相比于老叶片,病毒更少、症状更少,同时,转基因植株整体比野生型植株更抗病。
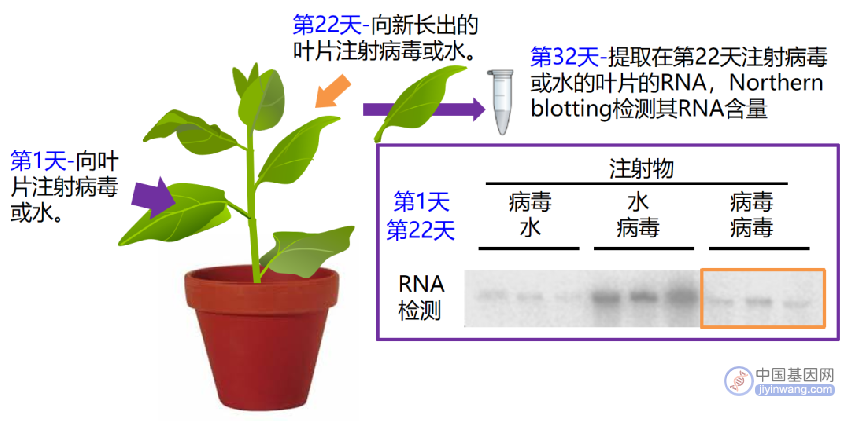
图4 对被感染植株中病毒RNA含量的检测 (Ratcliff et al., 1997)。第一次感染病毒后,第二次再次感染病毒,但此时引起了RNA沉默(黄色框内显示RNA含量极少),阻止了病毒的系统性侵染,使植物对病毒产生了抗性。
共抑制现象与抗病毒现象的关系
在很长的一段时间,研究者都沉迷在DNA无与伦比的魅力中——DNA被认为是表观遗传修饰的唯一目标,即通过染色质结构变化影响转录相对应的表观遗传变化。后来,才开始有一些研究者假设DNA之外也有其他分子以某种方式影响DNA传递的信息,例如RNA。
随后,越来越多的研究也显示,共抑制现象与抗病毒现象的确有很多的相似之处,例如表达源于病毒的某些基因的转基因植物可以抵抗病毒侵染;病毒也能使宿主基因发生沉默;侵染转基因植物的病毒能诱导与该病毒序列同源的外源转化基因发生沉默;两者均与RNA参与转录后的基因沉默有关,等等。
先说后来的研究结论吧:
在真核细胞中,基因表达和基因沉默共同决定了完整转录组的实现。在前文中我们了解到基于同源依赖的基因沉默分为TGS和PTGS(也称为共抑制),后者常作为真核生物的一种基于RNA的免疫机制,防御病毒和外源基因入侵,是植物抵御外来核酸侵入、保持自身基因组结构完整性的一种有效策略,这是植物与病毒在共进化过程中发展的一种基因表达调控机制(张新岩,2015)。
简单点说,其实就是,转基因产生的共抑制现象其实与植物本身抵抗病毒共享同一条信号通路(图5)。
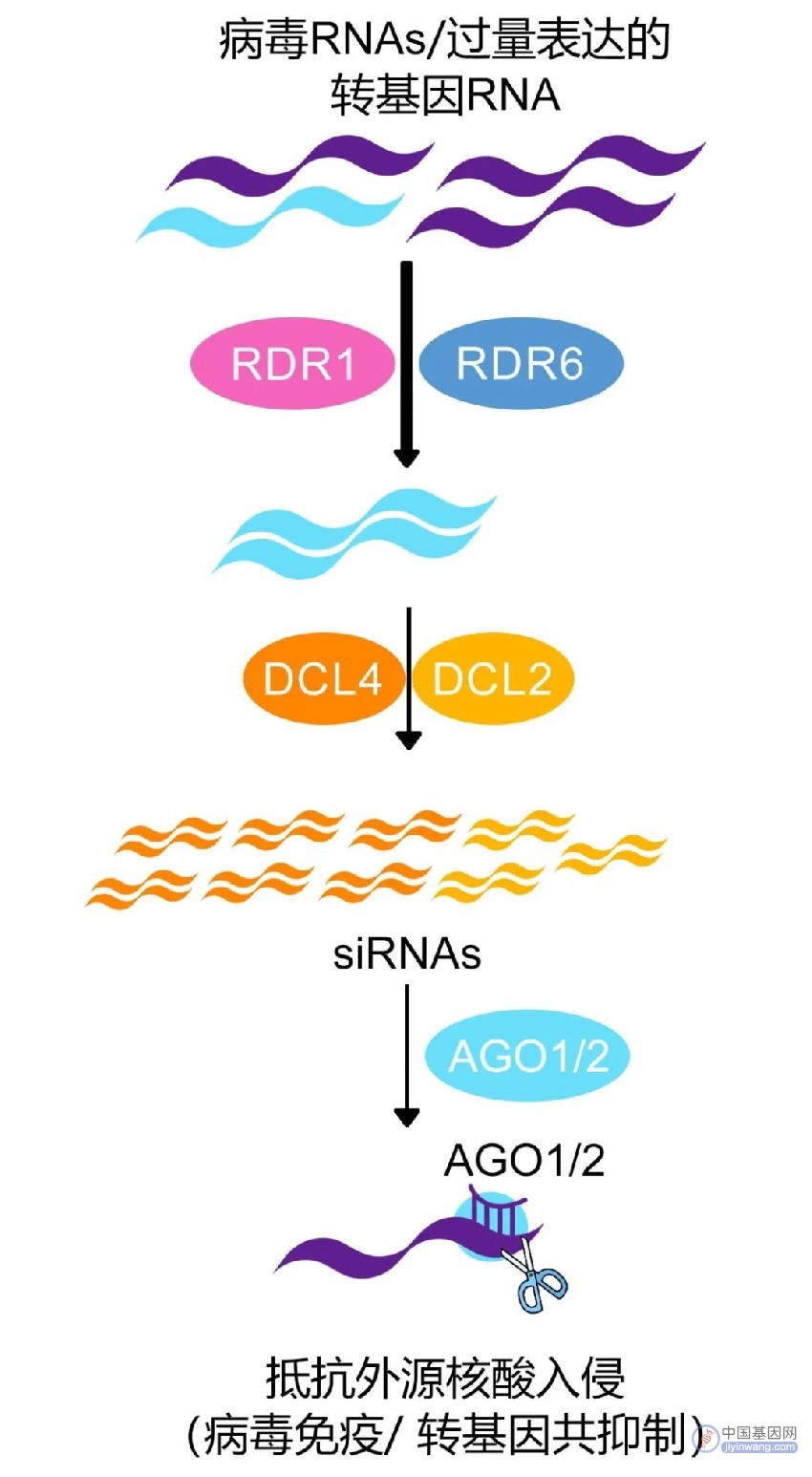
图5 植物抵抗外源核酸入侵的机制(张新岩,2015)。细胞内的双链RNA作为转录后水平基因沉默的启动者,可以被Dicer家族蛋白识别并剪切成20~22碱基长度的小RNA双链,植物siRNA双链主要由DCL2和DCL4蛋白剪切形成。小RNA双链的其中一条链可以被装载到一个包含Argonaute(AGO)蛋白的RNA介导的沉默复合体(RISC)中,导致mRNA剪切或抑制翻译。
在基因功能研究中的应用举例
——VIGS、hpRNA
搞清楚原理之后,我们能不能“以彼之道还施彼身”呢?
当然!
研究基因功能的常见技术——病毒介导的基因沉默(Virus induced gene silencing,VIGS)和发夹RNA(hairpin RNA,hpRNA)技术,即VIGS或hpRNA载体转入植物中可引发RNAi现象,利用的就是图5中的信号通路。
VIGS是利用病毒将目的基因序列引入寄主植物中,在复制过程中产生dsRNA从而引发RNAi现象,在瞬时转化或大规模基因功能研究方面具有优势,但需要注意,VIGS引发的RNAi不能稳定遗传。
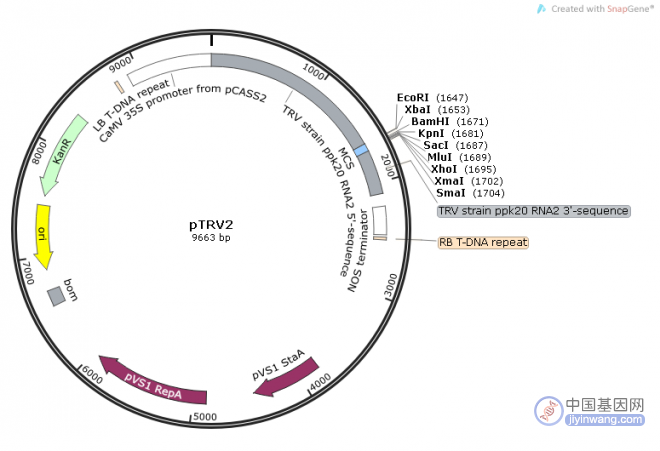
图6 VIGS载体。
hpRNA载体设计了目的基因的反向重复片段,将其转入植物中,转录形成发卡结构,经剪切后形成稳定的dsRNA诱导同源的内源基因沉默。
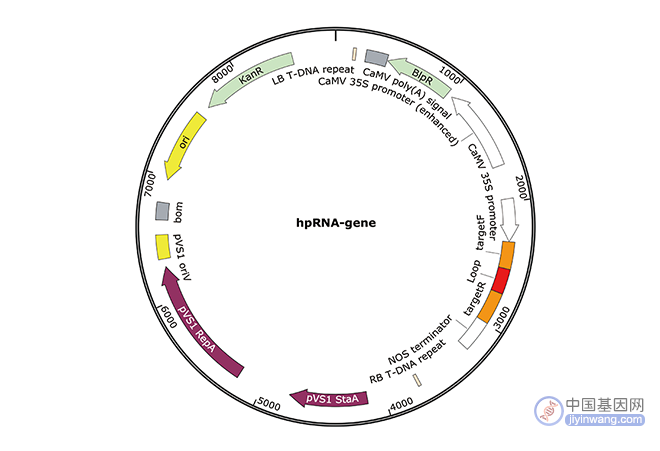
图7 发夹干扰载体。
关于共抑制的一些其他发现
高丰度表达的转基因很容易发生共抑制,共抑制的概率与驱动转基因的启动子强度相关(表1)(Que et al., 1997)。基因的拷贝数与表达量呈正相关,植物转基因的表达量越高,越容易发生共抑制现象 (Schubert et al., 2004)。
表1 不同启动子引发CHS基因发生共抑制的概率 (Que et al., 1997)。
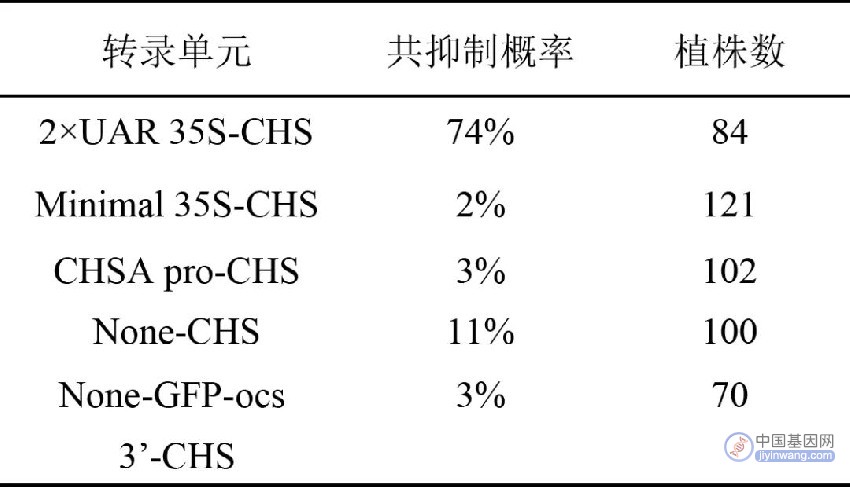
备注:UAR指上游激活区(Upstream activator region),None指无启动子。
植物内存在PTGS机制需要一个权衡:若没有PTGS机制存在,植物十分容易受到病毒的感染;但是太过灵敏,又容易使内源基因引发“自我攻击”。
新的问题又来了,内源基因为何一般不会引起PTGS呢?这可以归结为一个阈值模型。转基因产生的过量的有缺陷的转录本有些时候不能被完全降解,从而激活了PTGS,而植物对内源基因的PTGS设置了一个很高的阈值,因此正常情况下,大部分内源基因不会发生沉默。
如果遇到了转基因共抑制该如何解决?
利用单拷贝株系:
与单拷贝株系相比,多拷贝株系更容易发生共抑制现象,因此,为了得到稳定表达的株系,建议选择单拷贝株系做后续实验。
利用PTGS突变体:
利用PTGS突变体作为转基因受体材料是克服同源共抑制的一种有效方法。例如以sgs2 sgs3突变体作为受体材料,可以得到稳定且高表达的转基因株系,由35S启动子驱动的报告基因GUS在T1代拟南芥中100%表达,而以野生型植株作为受体材料时,由35S启动子驱动的报告基因GUS仅在20%的T1代拟南芥中表达 (Butaye et al., 2004)。
改造双元载体:
转录时3’端通读会产生没有poly A尾巴的RNA,这种RNA容易引发共抑制现象。有研究者使用含两份终止子的载体去抑制3’端通读,效果良好,报告基因GUS活性增加3-4倍,与GUS相关的siRNA含量减少。
不含内含子的外源基因经过转基因后,引发的基因沉默现象是含有内含子外源基因的4倍。因此使用全长基因进行转化也是可以考虑的喔!
研究RNAi的里程牌事件
请旋转手机
一起来看RNAi的里程碑发现吧~
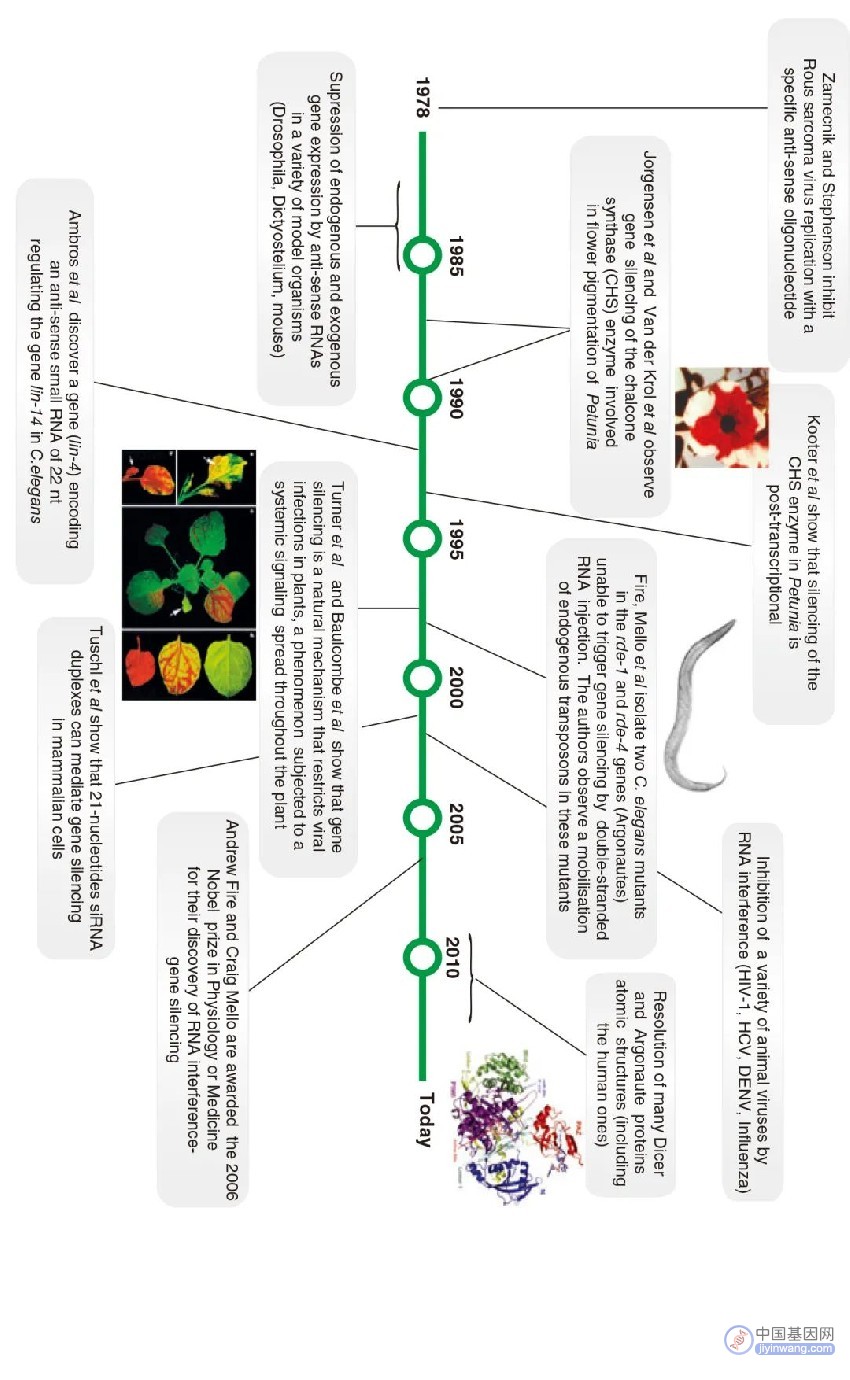
图8 RNA干扰(RNAi)研究中的里程碑事件(Karim Majzoub and Jean-Luc Imler,2015)。
在本篇文章,伯小远主要通过转基因植株常出现的现象——共抑制现象,来向大家讲述了其发现的过程,并将其与植物抗病毒现象作对比,还原了当时研究者们的研究历程,采用“古今结合”的方式,穿插着写了现象背后的原理,以及对原理的应用——VIGS技术和hpRNA技术,并给出了一些可避免出现共抑制现象的方法。看到这里,想必大家对于文章一开始提到的超表达植株里目的基因并没有被超表达的问题有了新的认识,以后大家在分析相关原因的时候记得把共抑制这个原因考虑进去哦!当然,上面提到的只是原因之一,更多的原因需要大家自己去探索哦!此外,关于RNAi方向的研究内容实在太多,篇幅所限,我们最后只能以一张图(图8)来让大家再次了解这个丰富多彩的领域。
References:
Butaye KM, Goderis IJ, Wouters PF, et al., 2004. Stable high-level transgene expression in Arabidopsis thaliana using gene silencing mutants and matrix attachment regions. Plant J 39, 440-9.
Karim Majzoub and Jean-Luc Imler, 2015. RNA Interference to Treat Virus Infections. Rev. Cell Biol. Mol. Medicine, 192-228.
Lindbo JA, Silva-Rosales L, Proebsting WM, Dougherty WG, 1993. Induction of a Highly Specific Antiviral State in Transgenic Plants: Implications for Regulation of Gene Expression and Virus Resistance. Plant Cell 5, 1749-59.
Napoli C, Lemieux C, Jorgensen R, 1990. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell 2, 279-89.
Que Q, Wang HY, English JJ, Jorgensen RA, 1997. The Frequency and Degree of Cosuppression by Sense Chalcone Synthase Transgenes Are Dependent on Transgene Promoter Strength and Are Reduced by Premature Nonsense Codons in the Transgene Coding Sequence. Plant Cell 9, 1357-68.
Ratcliff F, Harrison BD, Baulcombe DC, 1997. A similarity between viral defense and gene silencing in plants. Science 276, 1558-60.
Schubert D, Lechtenberg B, Forsbach A, Gils M, Bahadur S, Schmidt R, 2004. Silencing in Arabidopsis T-DNA transformants: the predominant role of a gene-specific RNA sensing mechanism versus position effects. Plant Cell 16, 2561-72.
Van Der Krol AR, Mur LA, Beld M, Mol JN, Stuitje AR, 1990. Flavonoid genes in petunia: addition of a limited number of gene copies may lead to a suppression of gene expression. Plant Cell 2, 291-9.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。