我国科研团队研发新型通用基因编辑工具 失明者有望重见光明!
据报道,视网膜色素变性可以由100多个不同基因的突变引起,是人类失明的主要原因之一,估计每4000人中就有一人受到影响。近日,武汉科技大学姚凯教授团队开发出一种新型基因编辑工具可逆转遗传性失明。
此项研究为国际上首次在成体动物上实现无限制性基因编辑,也是首次实现直接编辑视网膜神经细胞基因组,特别是不健康或濒临死亡的感光神经元。用这种方法治疗后的小鼠视力恢复接近正常,为视网膜色素变性等疾病的治疗带来了希望。相关研究已发表在《实验医学杂志》上。

姚凯团队(图源武汉科技大学官网)
视网膜色素变性是一种什么疾病?过去使用基因编辑技术治疗遗传性失明症的方法有哪些局限性?从动物实验成功到临床实验还有多远?
眼部症状切莫掉以轻心
武汉科技大学姚凯教授介绍,视网膜色素变性是指视网膜中的感光神经元发生病变。
感光神经元是日常生活中将外界光子转换为电信号的神经细胞,分为视杆细胞与视锥细胞。视杆细胞主要感知暗光,视锥细胞主要感知亮光和颜色,视网膜色素变性就是这两层细胞发生了病变。
这种变性主要与基因突变有关,目前已知有超过100种基因突变导致视网膜色素变性。绝大多数情况下,视杆细胞先出问题(即夜盲症),逐步演变为视锥细胞死亡,最终导致失明。其发病伴随着人的整个生命周期,下至2岁婴儿,上至70多岁老人都可能发病,给人带来极大痛苦。
因不同基因突变和不同的突变位点,会导致发病的年龄与速率存在很大差异,但总体上都是经历从晚上看不见,最后演变为白天看不见的过程。姚凯提示:“眼部出现任何症状时,都不能掉以轻心。”
让濒死的神经细胞活过来
目前,姚凯团队设计出的新型通用基因编辑工具已经成功完成了动物实验,让失明小鼠重见光明,但尚未在人体上应用。
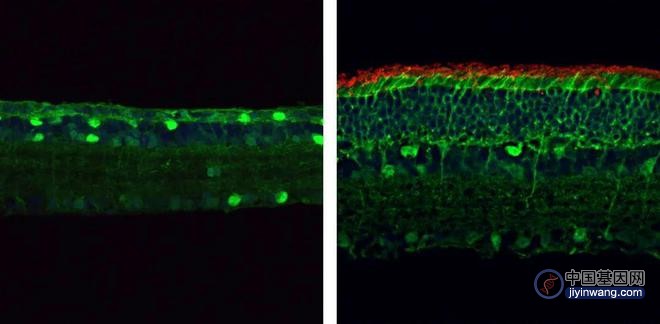
在四个月大时,携带PDE6β基因突变的小鼠(左)的视网膜变薄,缺乏杆状感光细胞(红色)。但是通过PESpRY系统纠正这种突变的小鼠(右)有更厚的视网膜,含有大量的杆状细胞
虽然,此前其他研究人员也曾使用基因编辑工具恢复小鼠的视觉。但他们的基因编辑所针对的是先天性黑蒙症,这一疾病会影响到视网膜色素上皮——附着在视网膜上为感光神经元提供滋养的色素细胞,导致感光神经元出现问题。因此,基因编辑只是在视网膜色素上皮这些细胞上进行,还未涉及视网膜神经细胞。
而此次姚凯团队新开发的基因编辑工具PESpRY,成功在神经细胞,特别是濒临死亡的神经细胞中进行基因编辑,是对过去视网膜色素上皮基因编辑工具的巨大突破。姚凯说,“这相当于把濒死的神经细胞从死亡线上拉了回来。”
不仅如此,以往的编辑工具存在两大不足:一是存在位置限制,只能在基因组特定位置编辑,一旦突变位点不在基因识别序列旁边就无法完成;二是存在突变类型限制,只能针对单碱基突变进行编辑,如果一个基因发生多个位点突变同样无法完成。而PESpRY通过对传统基因编辑工具的改造,对受位点限制的蛋白进行替换,并引入定点突变,有效解决了这两大不足,真正实现了既无基因组位点限制也无突变类型限制的无限制性基因编辑。
精准医疗?基因治疗药物指日可待
这项新的研究突破受到了国际上的高度评价。有了这项技术,在充分把握安全性的情况下,未来有望开发出一种基因治疗药物,通过手术的方式将药物注射到视网膜内腔,让其作用于感光细胞进行基因修复。
由于不同个体的突变基因存在差异,基因中产生突变的位点也不同,这些都可能需要不同的药物设计来有的放矢。所以,基因治疗药物与普通感冒药不同,属于精准医疗的范畴,姚凯说:“可能少数几个病人,甚至一个病人一种药物。”
姚凯表示,目前,国外在基因治疗上存在先发优势,体系更为健全,但随着相关制度的完善和各方面政策的支持,我国在这一领域也有着很大的发展潜力。
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。