年终盘点:肺癌捣蛋基因那些事儿----ROS1抑制剂
ROS1在1982年首次被发现,又名c-ros肉瘤致癌因子——受体酪氨酸激酶,是存在于UR2肉瘤病毒中的具有独特致癌作用的病毒原癌基因序列。2007年,在非小细胞肺癌(NSCLC)中首次发现了ROS1基因,阳性率为1%-2%,此后ROS1融合作为NSCLC患者的治疗靶点之一逐渐被关注,随后,其又在大肠癌、卵巢癌等恶性肿瘤中被检测出。
ROS1融合作为NSCLC中的一个经典的“钻石突变”,自发现以来,不断有新型靶向药物问世,但截至目前,克唑替尼仍是治疗ROS1融合阳性NSCLC患者的首要药物。

01
ROS1融合基因
ROS1属于胰岛素受体家族的成员,其在人类中的生物学作用尚未被完全阐明,未发现已知的配体。在人类中,ROS1基因位于6q21染色体上,由3部分组成,分别是胞内酪氨酸激酶活性区、胞外区以及跨膜区。ROS1基因出现重排时,会导致细胞外区域丢失,而跨膜区、胞内酪氨酸激酶区域得以保留,ROS1基因的32-36外显子是发生重排的主要位点。在NSCLC中,ROS1基因通过与SLC34A、CD74发生融合激活信号通路(下游PI3K/AKT、ROS1酪氨酸激酶区),进而诱发肿瘤。
在临床中,ROS1的特点与ALK易位患者极为相似,但其更多发生于年龄偏小(50岁左右)、女性、无吸烟史以及腺癌患者。此外,有研究表明,ROS1重排患者的生存期为37个月左右,较EGFR突变(25个月)、ALK(24个月)重排的患者处于较高水平,提示ROS1重排患者预后较好。
02
克唑替尼(Crizotinib)
I期PROFILE 1001研究证实了克唑替尼在ROS1阳性NSCLC患者中的有效性,该研究显示研究者评估的客观缓解率(ORR)为72%(95%CI:58%–83%),疾病控制率(DCR)为90%,中位反应持续时间((DoR)为24.7(95%CI:15.2-45.3)个月,中位无进展生存期(PFS)和总生存期(OS)分别为19.3(95%CI:15.2-45.3)和51.4(95%CI:29.3-未达到)个月。基于PROFILE 1001研究结果,FDA于2016年3月批准克唑替尼用于ROS1阳性NSCLC患者。
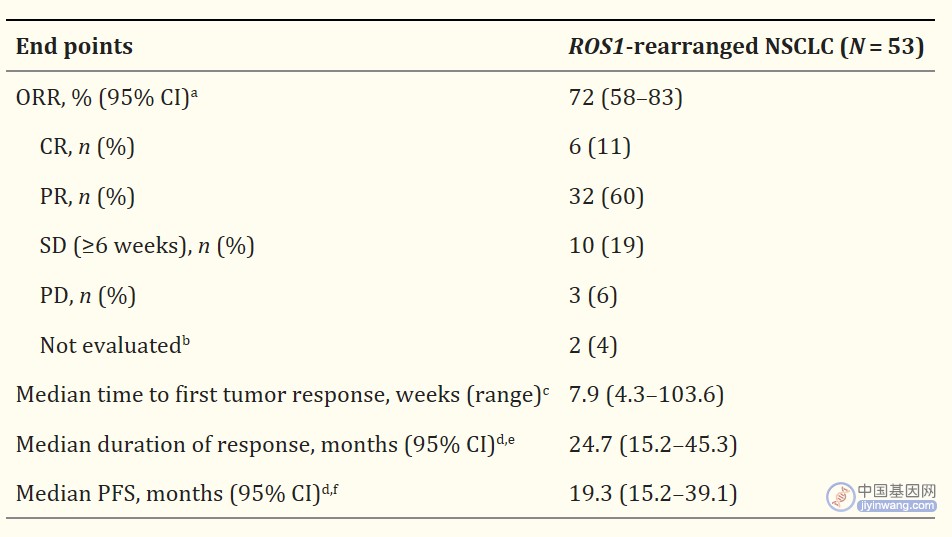
PROFILE 1001研究结果
OO12-01研究证实了克唑替尼在ROS1阳性亚洲晚期NSCLC患者中的疗效及安全性,研究结果显示,独立放射学审查(IRR)的ORR为71.7%(95%CI:63.0-79.3),其中17例完全缓解,74例部分缓解;IRR的中位PFS为15.9(95%CI:12.9-24.0)个月。NMPA于2017年9月批准克唑替尼用于ROS1融合阳性晚期NSCLC患者的治疗。
一项真实世界研究显示,克唑替尼用于ROS1阳性晚期NSCLC患者的中位OS为36.2个月,与OO12-1研究相似,但比PROFILE 1001研究短。与临床试验中调查的人群相比,该真实世界人群年龄较大,吸烟者和ECOG体能状态较差的患者比例更高。尽管如此,该研究结果支持克唑替尼在ROS1阳性晚期NSCLC患者中的临床获益。
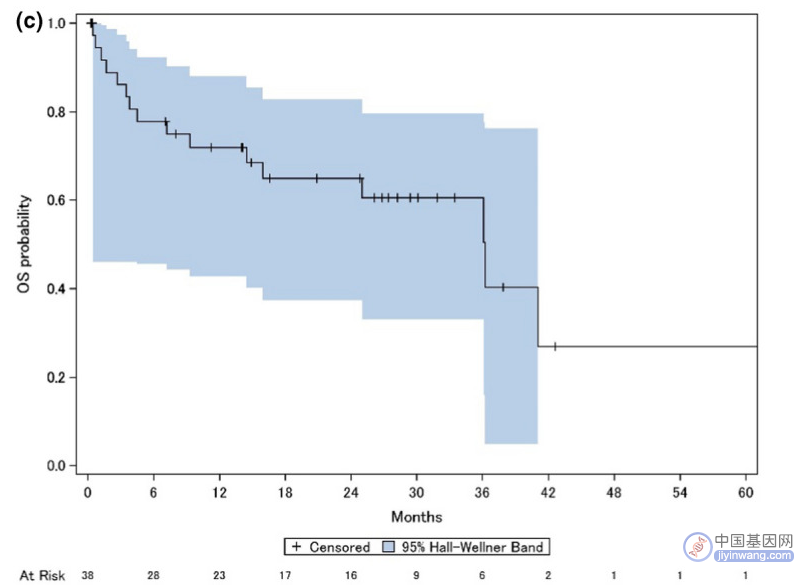
真实世界研究的OS结果
03
恩曲替尼(Entrectinib)
恩曲替尼是一种靶向ROS1、ALK或原肌球蛋白受体激酶(TRK)的多激酶抑制剂,可穿透血脑屏障,因此对脑转移特别有效。在体外,其抗ROS1活性比克唑替尼强40倍。2022年7月,NMPA批准恩曲替尼用于治疗ROS1阳性的局部晚期或转移性NSCLC成人患者。
II期篮子研究(STARTRK-2)的结果证实了恩曲替尼在161例ROS1阳性NSCLC初治患者中的疗效,其中34.8%的患者在诊断时有脑转移。对整体人群的最新分析发现,ORR为67.1%(95%CI:59.3–4.3),中位PFS为15.7(95%CI:11.0–21.1)个月,中位1年OS率为81%(95%CI:74–87);对于24例诊断时可测量的脑转移患者,集中评估脑部结局ORR为79.2%(95%CI:57.9–92.9),中位PFS为12个月。
04
洛拉替尼(Lorlatinib)
洛拉替尼是一种对ALK和ROS1具有活性的酪氨酸激酶抑制剂(TKI),具有较高的CNS穿透能力,对脑转移患者有较好的临床疗效。洛拉替尼对ROS1阳性NSCLC的抗肿瘤活性在I期试验中得到证实,随后在61例未接受TKI治疗(n=21)患者或既往接受克唑替尼治疗(n=40)患者给予另一种TKI(n=8)进行的I/II期试验显示,TKI初治患者的ORR为62%(95%CI:38-82),中位PFS为21(95%CI:4.2-31.9)个月,颅内ORR为64%(95%CI:31-89),颅内中位PFS未达到,进一步支持洛拉替尼对脑转移患者的良好疗效;在既往接受克唑替尼治疗的患者中,ORR、中位PFS和颅内ORR分别为35%(95%CI:21–52)、8.5(95%CI:4.7–15.2)个月和50%(95%CI:29-71)。
05
塞瑞替尼(Ceritinib)
塞瑞替尼是一种高效、高选择性二代ALK抑制剂,在克唑替尼治疗后进展的ALK重排NSCLC患者中表现出抗肿瘤活性和颅内疗效。体外研究结果也表明,塞瑞替尼可有效抑制ROS1激酶的活性。一项针对32例ROS1阳性NSCLC患者的II期研究中,30例初治患者接受塞瑞替尼治疗的ORR为62%(95%CI:45–77),中位PFS为9.3(95%CI:0–22)个月;在未接受克唑替尼治疗的初治患者亚组中,PFS持续19.3(95%CI:1–37)个月,与其他TKIs(恩曲替尼、洛拉替尼)相当;对于8例脑转移患者,颅内ORR为63%(95%CI:31–86%)。这些结果不足以支持塞瑞替尼挑战克唑替尼在ALK重排NSCLC领域的地位,但根据耐药及治疗进展情况,其在后线用药选择中可占据一席之地。
06
卡博替尼(Cabozantinib)
Cabozantinib是一种多靶点小分子TKI,主要针对VEGFR2、MET、FLT3、c-Kit及AXL等靶点,具有良好的脑渗透性。临床前研究和病例报告结果表明,Cabozantinib可通过与ROS1结合,对其他TKIs耐药的NSCLC患者有效,但存在D2033N或G2032R等耐药突变。相关研究显示,Cabozantinib单药或联合吉非替尼可抑制包括G2032R突变在内的ROS1耐药细胞株生长。目前针对Cabozantinib治疗ROS1阳性NSCLC尚缺乏研究数据,一项探索Cabozantinib治疗RET融合、NTRK融合、MET或AXL过表达、ROS1融合晚期NSCLC患者疗效的研究(NCT01639508)显示,纳入的11例TKI经治ROS1阳性晚期NSCLC患者,后线给予Cabozantinib治疗,取得了一定疗效,其中存在G2032R突变的患者癌灶更是缩小了近一半。
07
瑞普替尼(Repotrectinib)
Repotrectinib是一种抑制ROS1、TRK和ALK活性的广谱新一代TKI,其特性是能够通过血脑屏障。Repotrectinib疗效在基于ROS1阳性NSCLC患者的临床前模型中进行了评估,建模结果显示,Repotrectinib对ROS1阳性脑转移、ROS1阳性塞瑞替尼耐药和ROS1 G2032R耐药突变的NSCLC患者具有抗肿瘤活性。目前,一项在初治和TKI难治性晚期ROS1/TRK/ALK阳性实体瘤患者中评估Repotrectinib疗效的I/II期临床试验(NCT03093116)正在进行中。
08
他来替尼(Taletrectinib)
Taletrectinib是一种强效、新型、高选择性的新一代ROS1/NTRK抑制剂,可以克服克唑替尼耐药(包括携带G2032R突变的NSCLC),并穿透血脑屏障。临床前研究结果显示,Taletrectinib在源自ROS1阳性NSCLC患者的不同小鼠模型中具有疗效。Taletrectinib显示出对G2032R、L1951R、S1986F和L2026M突变的体外抑制活性,相比之下,其对D2033N突变的活性不太确定。目前,Taletrectinib的临床疗效正在两项I期试验中(分别在美国和日本)进行评估,前者(美国,U101,NCT02279433)招募了46例患者,Taletrectinib用于克唑替尼耐药患者的ORR为33%;后者(日本)在15例患者中进行,报告所有患者的ORR为58.3%,既往未接受克唑替尼治疗的患者占66.7%。Taletrectinib的颅内活性也被观察到,但仍有待证明。因此,如果疗效和耐受性得到证实,Taletrectinib或可在ROS1阳性NSCLC患者的治疗中发挥作用,特别是针对克唑替尼耐药的NSCLC患者。
09
耐药机制研究
克唑替尼用于治疗ROS1融合阳性NSCLC患者,在产生耐药机制并观察到疾病进展之前,疾病控制的中位持续时间为19个月,目前,除克唑替尼外,其他ROS1靶向药物的耐药机制尚未阐明。克唑替尼的耐药机制是多方面的:
ROS1激酶结构域修饰:该机制于2013年被首次报道,以G2032R突变最常见,占耐药机制的33%-41%,发生于ATP结合位点的溶剂前沿区域。目前,正在开发针对该突变的新一代TKIs,其中,Repotrectinib和Topotrectinib均取得了令人鼓舞的结果,Cabozantinib和Foretinib也显示出抗ROS1 G2032R的活性。
其他信号通路的激活:这些机制的激活可以产生——(1)ROS1刺激信号通路抵抗TKIs的抑制;(2)在其他原癌基因通路水平上获得新的突变或扩增。在前一种情况下,SHP2激活丝裂原活化蛋白激酶(MAPK)MEK/ERK通路赋予了TKIs耐药性;在第二种情况下,ALK、BRAF、KRAS、神经母细胞瘤RAS病毒(v-ras)癌基因同源物(NRAS)突变以及MET扩增既往均有描述。
表型转化:根据尸检结果,这种表型变化与视网膜母细胞瘤-1(RB1)和TP53基因失活以及ROS1融合表达的缺失有关。这种耐药机制在其他致癌驱动因素中(例如EGFR突变或ALK重排)有很好的描述。
小结
随着ROS1抑制剂的不断发展,针对ROS1重排NSCLC治疗方案的制定变得更具挑战性,治疗决策中需权衡CNS活性、耐药机制和耐受性等多个因素。关于一线治疗方案的选择,目前医学界尚存在诸多争议,但是,相信随着分子生物学的研究深入及基因相关技术的进步,ROS1重排的相关靶向治疗必将出现新格局,造福更多患者。
参考文献:
[1] 王英, 等. 医学理论与实践. 2022,35(14).
[2] A T Shaw, et al. Ann Oncol. 2019 Jul 1;30(7):1121-1126.
[3] Wu YL, et al. J Clin Oncol. 2018 May 10;36(14):1405-1411.
[4] Waterhouse D, et al. Target Oncol. 2022 Jan;17(1):25-33.
[5] Alexander Drilon, et al. Lancet Oncol. 2020 Feb;21(2):261-270.
[6] Rafal Dziadziuszko, et al. J Clin Oncol. 2021 Apr 10;39(11):1253-1263.
[7] Alexander Drilon, et al. Clin Cancer Res. 2016 May 15;22(10):2351-8.
[8] Drilon A, et al. Lancet Oncol.2016 Dec;17(12):1653-1660.
[9] Vivek Subbiah, et al. Sébastien Gendarme, et al. Curr Oncol. 2022 Feb; 29(2): 641–658.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。