《Nature》基因编辑69处猪器官基因后,猪肾移植受体食蟹猴存活期超2年
异种移植有机会解决全球器官短缺问题,但在临床应用之前,必须将人工改造的猪供体器官在非人类灵长类动物 (NHP) 模型中进行测试以确保其安全性和有效性。多年来,虽然已经创建了各种基因工程猪供体,但距其成功应用仍道阻且长,主要问题在于:1)供体猪的心脏和肾脏尺寸太大,虽然消除生长激素受体基因表达可以减少器官大小,但会带来其他不良反应【1】;2)供体器官在OWM中测试,但OWM作为测试受体的不足之处在于它们缺乏α-Gal或α-Gal/Sd(a)聚糖但表达Neu5Gc聚糖,体外分析数据表明与人类相容的猪供体理想情况下应该消除所有三种聚糖,以匹配人类中三种聚糖的缺失【2】;3)猪供体器官携带多种病毒,如猪内源性逆转录病毒 (PERV)【3】,以及在去年年初首例接受猪心移植患者体内检测到的猪巨细胞病毒(PCMV),可能是该患者死因之一。
2023年10月11日,来自eGenesis的Wenning Qin和Michele E. Youd团队在Nature杂志上合作发表了一篇题为Design and testing of a humanized porcine donor for xenotransplantation 的文章,他们对尤卡坦半岛小型猪供体进行69次基因编辑,以实现3种糖类抗原的消除、猪内源性逆转录病毒失活和7个人类转基因过表达,将供体猪肾移植到NHP体内并与临床相关免疫抑制方案相结合,可支持NHP长期存活达758天,这一研究成果使人们离基因工程猪肾脏移植的临床试验更近了一步。

研究者选取了与人体器官大小相当的尤卡坦半岛小型猪(下图)作为供体(『珍藏版』综述丨猪作为生物医学模型的重要性),利用CRISPR-Cas9破坏其编码3个糖类抗原的基因(GGTA1、CMAH和B4GALNT2L),同时灭活PERV元件并插入7个人类基因,包括来自补体级联的CD46和CD55、来自凝血途径的THBD和PROCR、参与先天免疫的CD47,以及抑制缺血再灌注损伤、细胞凋亡和炎症的TNFAIP3和HMOX1(以下简称为3KO.7TG.RI)。对接受此供体肾脏的NHP受体进行的RNA-seq和IHC显示,所有人类转基因均得到表达,且在移植后176天尸检时肾移植物中维持表达,大量的基因编辑也并未损害肾功能,供体肾小球滤过率与匹配的未编辑猪之间没有差异。

尤卡坦小型猪(Yucatan miniature pigs)。图片来源:Nature
为了确认在3KO基础上额外表达7个人类基因的效用,研究者将3KO.7TG.RI、3KO和WT猪细胞分别于人或食蟹猴血清共孵育,观察到前者表现出显著更少的补体系统效应分子C3b的沉积,尽管共孵育45分钟时WT猪细胞被裂解,单独的3KO修饰几乎完全消除了人血清的补体依赖性细胞毒性,但当时间延长至15小时,3KO修饰的保护作用微乎其微,但3KO.7TG.RI依然能抵御血清的细胞毒性,证明转基因人CD46和CD55在猪KECs上表达时可调节补体活性。另外,作者还通过测定TNF处理后caspase3/7的激活情况证明转基因TNFAIP3和HMOX1的抗凋亡作用,以及THBD和PROCR在参与调节人类全血凝固方面的作用。
接下来,研究者将3KO±RI供体猪肾和3KO.7TG±RI供体猪肾分别移植到不同食蟹猴体内,这些食蟹猴接受双肾切除及免疫抑制处理。6名3KO±RI肾移植受体的生存期很短,仅在移植第6天就出现肾功能衰竭,第50天出现严重水肿和蛋白尿。相比之下,3KO.7TG±RI受体的存活时间明显更长,中位存活时间为176天,在功能上,单个移植肾对代谢物(例如肌酐)的过滤足以补偿原肾的缺失。对于异种移植存活时间最长的受体(758天),在移植后第502天活检显示肾脏组织学基本正常,伴有斑片状纤维化,且在肾小球中观察到C4d染色(下图),表明C4激活,提示可能需要进一步改善免疫抑制方案。
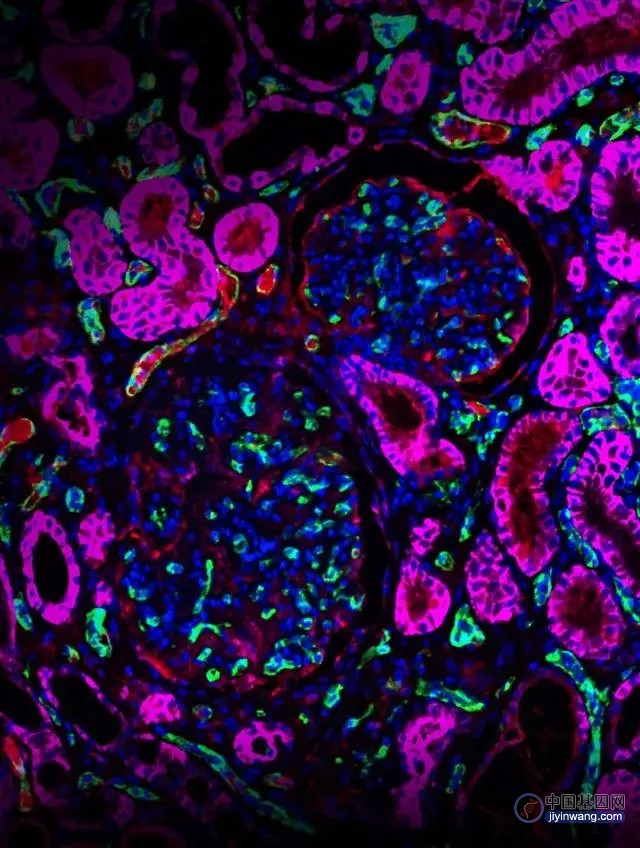
CRISPR编辑过的猪肾支撑非人灵长动物存活758天。绿色: CD31+ 内皮细胞; 紫红色, 人 CD46; C4d, 红色; 蓝色, 细胞核.Credit: Violette Paragas, eGenesis.
综上所述,这项工作证明源自3KO.7TG ± RI猪供体的肾移植物可支持食蟹猴生命长达758天。然而,除了敲除的3种糖类抗原外,在研究中仍观察到有异种抗原激活受体的免疫反应,因此,具有免疫耐受特征的基因工程猪模型可能是未来研究目标。
值得一提的是,同一期Nature杂志配发了题为Pig-to-primate organ transplants require genetic modifications of donor的News & Views以及题为的Monkey survives for two years after gene-edited pig kidney transplant新闻,盛赞了该项突破性工作。


原文链接:
https://doi.org/10.1038/s41586-023-06594-4
参考文献
1. Porrett, P. M. et al. First clinical‐grade porcine kidney xenotransplant using a human decedent model. Am. J. Transplant. 22, 1037–1053 (2022).
2. Estrada, J. L. et al. Evaluation of human and non-human primate antibody binding to pig cells lacking GGTA1/CMAH/β4GalNT2 genes. Xenotransplantation 22, 194–202 (2015).
3. Niu, D. et al. Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science357, 1303–1307 (2017).
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。