Cell:新研究揭示人类5000多个必需基因表型图谱
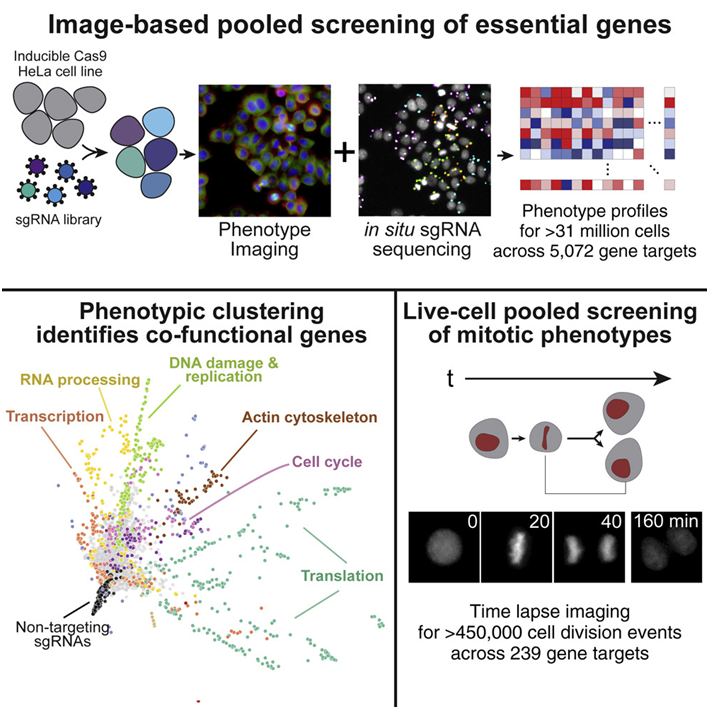
在一项新的研究中,来自美国怀特海德研究所和布罗德研究所的研究人员利用一种新颖的、集合的、基于成像的筛选方法系统性地评估了5000多个人类必需基因的功能。
他们的分析利用CRISPR/Cas9来敲除基因活性,并形成了一种首创的资源,能够通过空间和时间分辨率了解和可视化观察基因在一系列细胞过程中的空间和时间分辨率。他们的研究涵盖了超过3100万个细胞,包括数百个不同参数的定量数据从而能够预测基因如何工作和共同运作。相关研究结果于2022年11月7日在线发表在Cell期刊上,论文标题为“The phenotypic landscape of essential human genes”。
论文共同通讯作者、怀特海德研究所成员Iain Cheeseman说,“在我的整个职业生涯中,我一直想看看当一个必需基因的功能被消除时,细胞中会发生什么。如今,我们可以做到这一点,不仅仅是针对一个基因,而是针对在培养皿中分裂的人类细胞中的每一个重要的基因,这是非常强大的。我们所创建的资源不仅会使我们自己的实验室受益,而且会使世界各地的实验室受益。”
必需基因控制着细胞生存所需的基本功能(转录、mRNA剪接、翻译、囊泡转运、DNA复制、细胞分裂等)。系统性地破坏这类基因的功能并不是一个新概念,但传统方法受到各种因素的限制,包括成本、可行性和完全消除必需基因活性的能力。
Cheeseman和他的同事们与论文共同通讯作者、布罗德研究所的Paul Blainey及其团队合作,确定并实现这一雄心勃勃的联合目标。Blainey团队开创了一种新的基因筛选技术,该技术结合了两种方法---大规模的、集合的、使用CRISPR/Cas9的基因筛选和细胞成像---以揭示定性和定量差异。此外,与其他方法相比,该方法价格低廉,并可使用市面上的设备进行操作。
Blainey说,“我们很自豪地展示了与怀特海德研究所的Cheeseman实验室合作,用低成本的成像检测方法以令人难以置信的分辨率可视化观察细胞过程。很明显,这只是我们方法的冰山一角。根据更详细的表型数据将遗传扰动联系起来的能力对于未来的许多研究领域来说是迫切需要的,而且如今对许多领域的研究都是可行的。”
Cheeseman补充说,“进行集合细胞生物筛选的能力只是从根本上引起了技术变革。你让两个细胞相邻,因此你对它们是否相同进行统计学意义上的计算的能力就高得多,你可以分辨出非常小的差异。
Cheeseman、Blainey、论文共同第一作者Luke Funk和Kuan-Chung Su以及他们的同事们评估了一种人类细胞系中5072个必需基因的功能。他们在这种筛选中分析了这些细胞中的四种标志物---DNA;DNA损伤反应,即一种检测和应对受损DNA的关键细胞途径;两种重要的结构蛋白:肌动蛋白和微管蛋白。
除了他们的初步筛选之外,这些作者还进行了较小的后续筛选,着重关注参与细胞分裂(也称为“有丝分裂”)的大约200个基因。这些基因在他们的初步筛选中被确定为在有丝分裂中发挥了明确的作用,但以前并没有与该过程相关。这些数据通过一个名为Vesuvius的配套网站提供,为其他科学家研究他们感兴趣的基因的功能提供了资源。
图片来自Cell, 2022, doi:10.1016/j.cell.2022.10.017。
Cheeseman说,“我们在这些细胞上收集了大量的信息。比如,对于这种细胞系的细胞核,不仅仅是它的染色有多亮,而是它有多大有多圆,它的边缘是光滑的还是凹凸的?计算机真地可以提取大量的空间信息。”
从这些丰富的多维数据中,这些作者的研究工作为筛选中分析的每个必需基因提供了一种细胞生物学“指纹”。利用复杂的计算聚类策略,他们可以将这些指纹相互比较,并构建必需基因之间的潜在调节关系。由于他们的数据证实了多种人们已经知道的关系,它可以被用来自信地对那些功能未知的和/或与其他基因的相互作用未知的基因进行预测。
这些作者的筛选数据中出现了许多值得注意的发现,包括一项令人吃惊的与离子通道有关的发现。两个在有丝分裂(特别是在染色体的适当分离中)中的作用而被确认的基因---AQP7和ATP1A1。这两个基因编码膜结合蛋白,将离子运入和运出细胞。Cheeseman,“在我研究有丝分裂的所有年头里,我从未想象过离子通道会参与其中。”
他补充说,“我们真的只是从我们的数据中挖掘出皮毛。我们希望其他人不仅能从中受益,而且还能在此基础上有所发展。”
参考资料:
Luke Funk et al. The phenotypic landscape of essential human genes, Cell, 2022, doi:10.1016/j.cell.2022.10.017.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。