CRISPR/Cas9:基因编辑的新方法
就像人类一样,细菌也会生病。有些细菌拥有自己的防御系统——CRISPR/Cas9,从而保护自身不被病毒感染。在过去的十年里,科研人员对CRISPR进行了改造,从而能够在实验室内编辑不同生物的DNA。这篇文章将介绍CRISPR/Cas9的基本原理和初步应用。需要注意的是,任何使用CRISPR/Cas9的实验都必须遵从道德规范,科研人员需要确保研究尊重人权、动物福利并遵守法律。

01
细菌是如何防御病毒的
没有人喜欢生病,更没人喜欢咳嗽、打喷嚏、发烧和头疼。这些反应是我们自身的免疫系统在对抗入侵的病原体,包括病毒、细菌等等。不过,有些病毒也可以感染细菌,它们被称为噬菌体(bacteriophage)。虽然与人类的免疫系统有很大不同,但细菌也有一个防御系统,保护它们免受感染。这个系统就是CRISPR/Cas9 [1]。
当噬菌体感染细菌时,噬菌体会将自身的DNA注入细菌。细菌识别到这些入侵的DNA,并在CRISPR/Cas9的帮助下将噬菌体的DNA切成碎片,从而避免DNA起效并阻止感染。之后,细菌会保留一些碎片,当下一次相同的噬菌体再次感染时,细菌就能迅速识别并更快地作出反应。
CRISPR的全称是“规律间隔成簇的短回文重复序列”(Clustered Regularly Interspaced Short Palindromic Repeats)。这个名字很拗口,不过恰如其分地解释了这个系统的特点。
就像绝大多数生物一样,细菌也使用DNA作为自己的遗传物质。DNA由四种不同的核苷酸构成,用英文字母表示就是A(腺嘌呤)、G(鸟嘌呤)、C(胞嘧啶)和T(胸腺嘧啶)。这些字母的排列决定了生物体的遗传信息和大多数性状,就像是生命的“源代码”。有些排列方式则可以构成回文序列,就像“上海自来水来自海上”这样,DNA的回文序列就像是“TAGCGAT”这样。
CRISPR的序列都是较短的回文序列。这些回文序列会在一些临近的区域重复多次出现,因此称为“成簇”和“重复”。然而,这些序列之间还有一些其它序列将其隔开,这些其它序列被称为“间隔”。合并起来,CRISPR就叫作“规律间隔成簇的短回文重复序列”。而Cas9是在CRISPR系统中起关键作用的一种蛋白质。
02
CRISPR/Cas9有什么用
那么,CRISPR是如何帮助科研人员编辑DNA的呢?实际上,这是一项非常重要的科学突破,2020年的诺贝尔化学奖就颁发给了改造这套系统的两位科学家:Emmanuelle Charpentier 和 Jennifer A. Doudna(图1)。

图1 - 2020年诺贝尔化学奖。
如前所说,组成DNA的核苷酸的排列方式决定了生物体大多数的性状。不同的性状是由不同的基因决定的,基因就是一小段“有用”的DNA。比如说,如果我们知道一个基因控制着狗狗毛发的颜色,那么改变这个基因中核苷酸的排列方式,毛发的颜色就会发生变化(图2)。
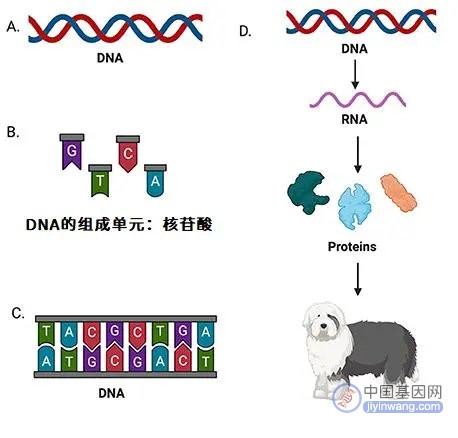
图2 - 要理解CRISPR/Cas9编辑基因的原理,首先需要了解这个系统的各个组成部分。
科研人员需要先确定他们想要编辑的基因是什么,以及他们想要实现的功能。这项工作可以通过生物信息学手段来开展研究。在知道基因序列后,研究人员就需要设计一段引导RNA(guide RNA,gRNA),并使用Cas9这种特殊的蛋白质。Cas9就像是一把分子剪刀,它能剪开DNA,但是需要gRNA来定位。gRNA是根据目标基因来设计的一段特殊的核酸序列,它能够和要编辑的基因序列互补结合,从而给Cas9提供“GPS坐标”,让Cas9到达正确的位置(图3A)。gRNA包含了一个称作PAM的位点,这就是给Cas9的“信号”,让Cas9能找到gRNA并在指定的位置切割DNA(图3B)。
切割完成后还需要一段修复模板(repair template),这是一段包含新序列的DNA,它能够结合到剪开的位置,并在其它蛋白的帮助下,在原基因的位置生成新的序列(图3C)。这样,科研人员就可以复制、粘贴、添加或删除DNA序列的部分内容,就像在word文档中编辑句子一样!比如,假如研究人员想要在一个基因中插入ATGCTA这个序列,那么修复模板将包含ATGCTA,并在其两端添加与原始基因相匹配的DNA,从而告诉修复模板该去哪儿。这样,在DNA修复完成后,新的序列就会粘贴到DNA上的目标位置(图3D),从而得到编辑好的基因。
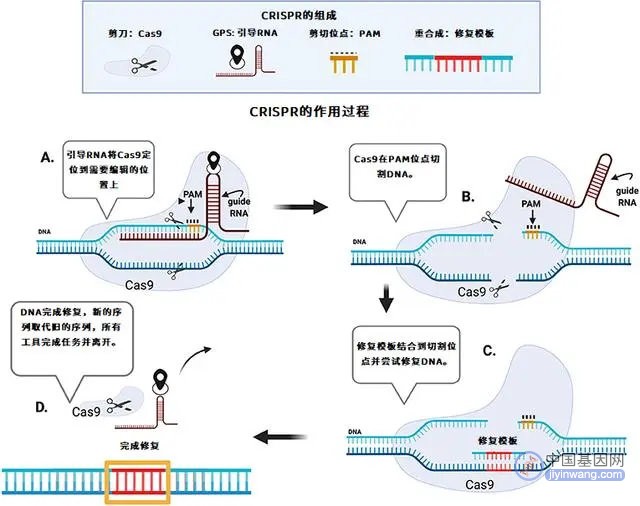
图3 - 使用 CRISPR/Cas9 编辑基因。
那么,有了CRISPR/Cas9基因编辑工具,它能用来做什么呢?图4展示了一些例子。目前,CRISPR最常应用在实验室环境中的细菌、酵母、线虫、植物和小鼠上[2],从而让科学家们理解许多基因的功能。由于人类的许多基因和动物同源,科学家也因而得以推测相关基因在人体内的作用。
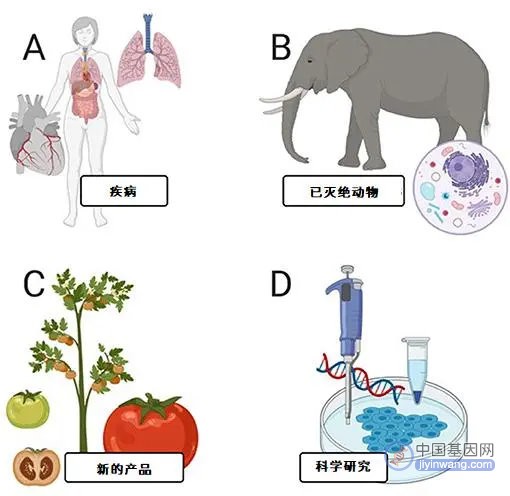
图4 - 基因编辑的应用。
有些人类疾病是由于DNA的错误所引起的,它们可以一代一代地传递下去。科学家和医生们正合作使用CRISPR/Cas9来尝试治疗由于DNA错误所引起的这些疾病,这种疗法被称为基因疗法(gene therapy)。基因疗法是一个崭新的事物,目前还没有在人体上完全测试过。不过,如果CRISPR/Cas9基因疗法能够体现出对人体的安全性,那么它或许将成为一种极有价值的方法,从而治疗并治愈遗传病人。
另一方面,一些商业公司也尝试使用基因编辑技术来创造新的产品。比如,一些研究者正尝试改变番茄的DNA,使其能产生辣椒素(capsaicin),让番茄体现出甜辣的味道。辣椒酱的口感将变得更加丰富!其他科学家也在使用CRISPR/Cas9来开发新的玉米品种,从而让它们在气候干旱、热浪侵袭的条件下也能正常生长,这或许有助于解决全球粮食危机。
一些科学家还相信,他们可以使用CRISPR/Cas9来使已灭绝的动物复生!想象一下,如果能看到活生生的猛犸象或恐龙四处走动,那该有多酷!一些科学家已经成功使用CRISPR/Cas9改变了大象的细胞,使其含有已灭绝的猛犸象的DNA,从而有助于让大象跟猛犸象一样拥有毛茸茸的皮毛,在寒冷的天气中更好地生存。
03
关乎道德的选择
尽管CRISPR/Cas9的应用前景令人遐想,但科学家群体正呼吁着国际社会立法规范这一技术的应用。任何技术的使用都应以安全和伦理作为前提。科研伦理是规范科学家行为的道德准则,它约束着科学成果必须保护公众的健康和安全,确保每一项研究都合乎人权、动物福利和法律规章,从而防止拥有先进技术的科学家伤害到人、动物或是环境。由于CRISPR/Cas9简单易行、成本低廉,几乎很难控制这项技术的使用者和使用目的[3]。从当前的情况考虑,只有出于预防或治疗现有疾病使用CRISPR/Cas9才被认为是合乎伦理的;出于其它目的的使用仍具有很大的争议,比如复活一只猛犸象。
目前的CRISPR/Cas9还不能做到非常精准的基因编辑。CRISPR/Cas9可能会结合到错误的位置,从而编辑了其它的基因,并带来一系列后果,这被称为脱靶效应。你会愿意在你的后代出生前编辑一个基因,而一个错误的编辑可能导致严重的后果吗?绝大多数科学家反对这样巨大的风险[4]。
科学研究必须考虑潜在的危害,特别是当这项技术被不负责任地滥用时,其带来的后果对于被编辑的个体而言可能是毁灭性的。出于这个原因,世界卫生组织和其它机构正紧密地监控、审查人类基因编辑的研究项目,确保这些研究都遵守恰当的规范。
04
总结
CRISPR/Cas9系统使细菌免受病毒侵害。现在,科学家也用它来在实验室里编辑DNA,这有助于我们更多地理解DNA的工作原理,并能治疗疾病、开发新产品。如果以负责任的方式使用CRISPR/Cas9技术,它有很多好处。然而,研究必须遵循伦理规则,以确保没有人在这个过程中受到伤害。有时,新技术的发展太快了,以至于科学家和政策制定者都没来得及反应。因此,科学家在努力改善人类生活的同时,必须始终思考自己所做事情的风险。
05
参考资料
[0] Marnik E, Bautista C, Drangowska-Way A, Simopoulos C and Merritt T (2021) CRISPR: A New Way for Scientists to Edit DNA. Front. Young Minds. 9:600133. doi: 10.3389/frym.2021.600133 [licensed under CC-BY]
[1] Hsu, P. D., Lander, E. S., and Zhang, F. 2014. Development and applications of CRISPR-Cas9 for genome engineering. Cell 157:1262–78. doi: 10.1016/j.cell.2014.05.010
[2] Zhang, S., Guo, F., Yan, W., Dai, Z., Dong, W., Zhou, J., et al. 2019. Recent advances of CRISPR/Cas9-based genetic engineering and transcriptional regulation in industrial biology. Front. Bioeng. Biotechnol. 7:459. doi: 10.3389/fbioe.2019.00459
[3] Brokowski, C., and Adli, M. 2019. CRISPR ethics: moral considerations for applications of a powerful tool. JMB 431:88–101. doi: 10.1016/j.jmb.2018.05.044
[4] Cyranoski, D. 2019. The CRISPR-baby scandal: what’s next for human gene-editing. Nature. 566:440–42. doi: 10.1038/d41586-019-00673-1
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。