《自然·生物技术》新型声学报告基因,让超声能实时监测肿瘤!
超声波被发射到人体内并遇到界面时会发生折射和反射,由于不同组织器官的形态结构存在差异,其反射或折射超声波的程度也有所不同。这样,通过相应的仪器发射和接收超声波信号,就可以大概模拟出检测目标的结构特征。
传统的超声医学成像中,通常需要使用到造影剂进行辅助成像,这是一种含有特殊构造微泡的液体。它们有着很强的声阻抗,反射声波的能力远高于血液、淋巴液等体液以及各种组织细胞。
为了对指定病灶进行造影,传统的方法常常会对微泡进行相应改造,以使其具有特异性靶向的能力。在最近的研究中,研究人员们将与天然气体囊泡表达相关的基因簇引入到细菌[1]或哺乳动物细胞[2]内,开发了第一代声学报告基因(ARG)系统。
然而,该系统目前仍存在着灵敏度低、特异性差等缺陷。近日,来自加州理工学院的Mikhail G. Shapiro团队在《自然·生物技术》上发表了一项重要研究[3],通过引入两种囊泡表达基因簇,在小鼠体内产生了更强、更稳定的超声信号,这一成果有望为肿瘤的非侵入式检测提供新的强大工具。

论文首页截图
气体囊泡(GV)是一种存在于水生细菌和古菌中的蛋白质纳米结构,其内部充满了低密度的气体,能够协助这些微生物在水体中进行悬浮与沉降。最近的研究将GV表达基因簇引入到细菌或哺乳动物细胞中,开发了第一代ARG系统,该系统虽然有着广阔的应用前景,然而,其在体内检测方面的应用仍存在着较大的限制。例如,这些细菌或哺乳动物中产生的GV不能产生非线性散射(这会导致难以与背景组织区分)、在体温(37℃)条件下表达水平低以及异源表达带来的高代谢负荷等等。因此,目前急需开发出更强大、更高效的新一代ARG系统。
GV由多顺反子基因簇进行编码,这包括一个或多个基本结构基因gvpA和7-20个(甚至更多)的次要成分编码基因。
在这项研究中,研究人员首先克隆了15种GV操纵子(其中13种来自11个在自然状态下能产生GV的代表性物种,2种为此前研究中在大肠杆菌中验证过的),并将其转化到大肠杆菌中。出于体内应用的特殊要求,研究人员对这些基因簇在不同温度和诱导剂浓度下的表现进行了表征。其中,在超声检测方面,与传统的破坏性脉冲序列不同,研究人员在这里使用了交叉传播的振幅调制脉冲序列(xAM),这种脉冲序列能够在抵消线性背景散射的同时,增强非线性造影剂的信号。
经检测,所有的15个基因簇中,有3种基因簇能够在37℃下表达并显示出大量xAM信号,5种能在30℃下表达并显示大量xAM信号。从来源物种的角度看,这几种基因簇分别来自水华鱼腥藻(Anabaena flos-aquae)、巨大芽孢杆菌(Bacilus megaterium ΔgvpA-Q),bARG1(水华鱼腥藻和巨大芽孢杆菌的杂交体),空泡脱硫杆菌(Desulfobacterium vacuolatum)和沙雷氏菌(Serratia sp. 39006)。
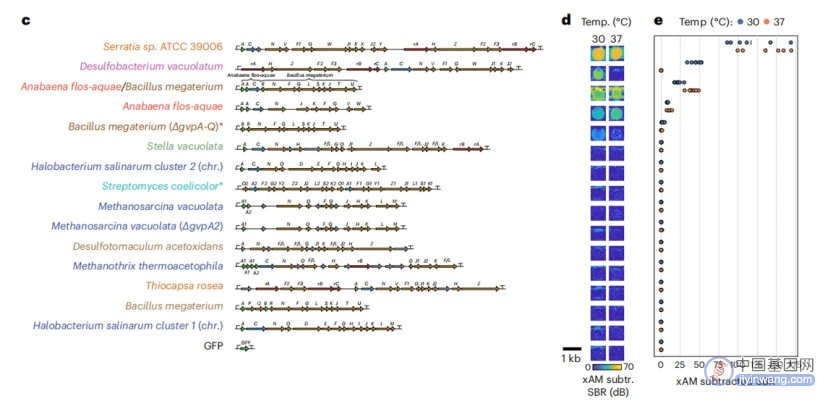
图1 不同物种来源的ARG基因簇在37℃和30℃下的xAM信号
为了对这些基因簇的性能进行定量比较,研究人员将相同密度的大肠杆菌(转化了上述五种生物来源的基因簇)接种在了水凝胶中,然后采用xAM进行成像,并使用相差显微镜(PCM)进行观察。结果表明,转化了来自沙雷氏菌、空泡脱硫杆菌和bARG1基因簇的大肠杆菌能够产生明显的xAM信号,PCM观察则发现除了来自水华鱼腥藻的基因簇外,其它四种基因簇均能表达出足量的GV。在超声信号和GV表达水平方面,来自沙雷氏菌的基因簇表现得最为出色。
异源蛋白的过表达会对宿主细胞产生代谢需求,因此,研究人员推测删除一些非必需基因可能会进一步改善沙雷氏菌基因簇的GV表达。经检测,研究人员发现缺失Ser39006_001280基因既增加了xAM信号,又增加了细胞的不透明度(用来表征GV的表达水平)。基于这些结果,研究人员在后续的实验中都使用这种操纵子(Serratia Δ Ser39006_001280)作为研究对象,并将其命名为bARGser。
为了进一步探索体内应用的潜力,研究人员又将bARGser基因簇引入到了EcN中,这是一种能够在胃肠道中存活以及在肿瘤中定植的大肠杆菌,被广泛用于测试活体工程菌疗法的有效性。经测试,研究人员最终在三种诱导型启动子中选择了L-阿拉伯糖诱导的pBAD启动子,该启动子在37℃时能稳定的控制GV的诱导表达。
随后,研究人员又测试了bARGSer在活体肿瘤中的成像能力。具体来说,研究人员在小鼠皮下生成了MC26肿瘤,并静脉注射了含有pBAD-bARGSer-AxeTxe质粒的EcN细菌,在注射细菌三天后,研究人员再通过GV诱导表达和超声成像进行检测。
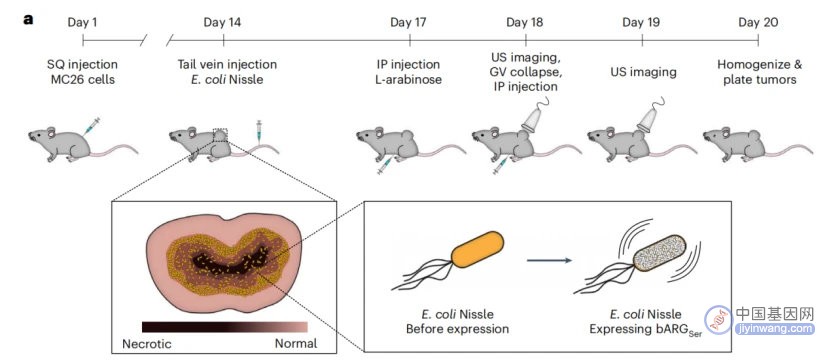
图2 bARGSer系统的体内验证
结果表明,只有添加诱导物并注射了工程菌的小鼠肿瘤中观察到了明显的超声信号,未注射工程菌或注射表达荧光蛋白的工程菌的小鼠即使添加诱导物也未产生信号,而注射工程菌但不添加诱导物的小鼠也产生了轻微的信号,这可能是由于饮食中存在的少量L-阿拉伯糖引起了GV的诱导表达。随后研究人员也对工程化EcN的定植情况进行了确认,总之,引入了pBAD-bARGSer-AxeTxe质粒的工程化EcN能在小鼠体内实现稳定、非破坏性的声学成像。
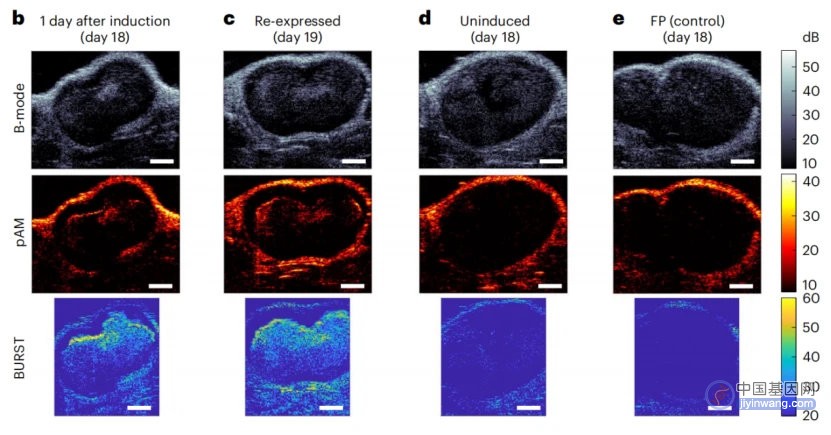
图3 工程化EcN能在小鼠体内实现稳定、非破坏性的声学成像
在细菌中得到验证之后,研究人员对此前研究中表现同样不佳的哺乳动物GV表达基因簇(mARGMega)也进行了迭代与改良。研究人员通过共转染将单顺反子形式的GV表达基因引入到HEK293T细胞中。考虑到天然水华鱼腥藻中gvpA基因存在多拷贝的现象,研究人员又对共转染物中gvpA基因的量进行了调整与测试,结果发现,在gvpA的相对浓度为8倍时,GV的生成达到了峰值。
此前研究中开发的mARGMega系统最大的问题是其不能产生非线性信号,此前的体外实验表明,GvpC蛋白能通过加强GV壳层来减少超声引发的形变(从而降低非线性信号),因此研究人员尝试去除了共转染物种的gvpC基因,结果发现转染后的细胞中xAM信号发生了显著增强(较添加了gvpC的增强了38.8倍),相比之下,不论是否去除gvpC基因,转染mARGMega基因的细胞中xAM信号都未发生太大改变。
为了便于操作,在之后的研究中,研究人员使用P2A共翻译切割元件将gvpNJKFGWV(水华鱼腥藻基因簇中除gvpA和gvpC的其它基因)连在一起,构建了多顺反子质粒,而将gvpA单独构建在另一个质粒上(以便调整其相对剂量),这两个质粒组成的系统被称为mARGAna。
最后,为了测试mARGAna质粒系统在活体内的表现,研究人员通过原位注射转染了mARGAna的MDA-MB-231细胞构建了小鼠乳腺癌模型。之后再进行诱导表达和超声成像,结果表明,经过诱导的小鼠肿瘤组织产生了强烈而特异的xAM信号,而未经诱导的组织中则无信号,这一结果直接证实了mARGAna在活体动物中进行无创超声成像检测的能力。
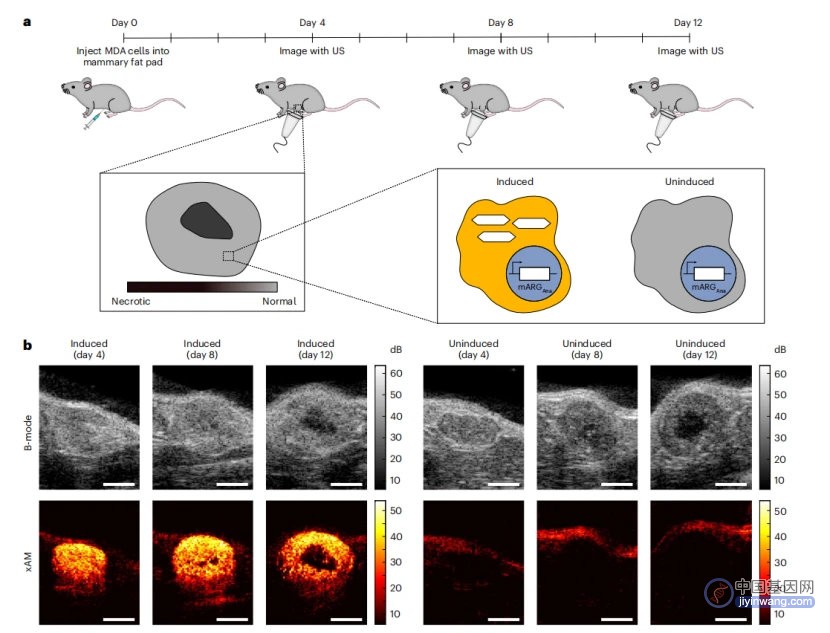
图4 bARGAna系统的体内验证
总的来说,该研究构建了两种新的ARG系统——bARGSer和bARGAna,它们分别能在细菌和哺乳动物中表达,并提供高特异性、高灵敏度的活体超声成像,这一发现大大拓宽了ARG系统在肿瘤等疾病诊断中的应用前景。希望将来这一技术的日益完善能够为广大患者提供新的诊疗手段。
参考文献
[1] Bourdeau RW, Lee-Gosselin A, Lakshmanan A, et al. Acoustic reporter genes for noninvasive imaging of microorganisms in mammalian hosts. Nature. 2018;553(7686):86-90. doi:10.1038/nature25021
[2] Farhadi A, Ho GH, Sawyer DP, Bourdeau RW, Shapiro MG. Ultrasound imaging of gene expression in mammalian cells. Science. 2019;365(6460):1469-1475. doi:10.1126/science.aax4804
[3] Hurt RC, Buss MT, Duan M, et al. Genomically mined acoustic reporter genes for real-time in vivo monitoring of tumors and tumor-homing bacteria [published online ahead of print, 2023 Jan 2]. Nat Biotechnol. 2023;10.1038/s41587-022-01581-y. doi:10.1038/s41587-022-01581-y
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。