悲壮的“基因斗争”:为阻止“跳跃基因”,胚胎细胞开启自我毁灭
每个人的人生旅程都始于一个细胞(受精卵),这个细胞以指数级分裂,逐渐分化出不同的器官,形成每一个独特的你我。这其中的每一个步骤都在基因的指引下有序进行,一旦基因出错,生命将会偏离正常轨道,甚至湮灭。人类和所有其他生物一样,与有害基因进行着永无止境的斗争。然而,在胚胎发育的早期阶段,尚无法建立起基因防御机制,面对基因损伤,胚胎细胞选择了死亡,启动自我毁灭进程。
胚胎的发育不是一蹴而就的,而是循序渐进的。从受精卵开始,胚胎需要先后经过2细胞阶段、4细胞阶段、8细胞阶段(E3)、桑葚胚阶段(E4),然后是囊胚阶段(E5开始)。囊胚内是内细胞团(ICM),ICM产生了外胚层,然后才是胚胎。早期胚胎发育时期,基因转录活跃、蛋白质大量合成以及细胞所处环境在不断变化,细胞对外界的刺激十分敏感,甚至会发生细胞凋亡,导致胚胎发育停滞,从而出现流产和辅助生殖技术(ART)失败。ICM是胚胎起源的关键细胞类型,但出现时间较短,无法捕捉和识别,难以定义。了解ICM发生的细胞凋亡,对人类个体发育过程极为关键。
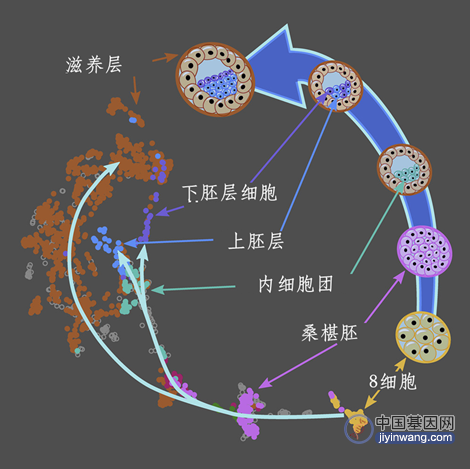
图1 胚胎发育阶段(图源:[1])
在探寻ICM细胞凋亡的原因时,科学家把目光锁定在了有“自私基因”之称的“转座子”身上。转座子本质上是一些DNA序列,只不过它们带着属于自己的一段序列,通过转座原件跳跃定居,在不同的染色体之间或者同一染色体间的不同位点之间转移,在染色体上复制粘贴,插入自己的序列,因此,转座子又被称为“跳跃基因”。转座子就像一个“熊孩子”,我们无法预测它会去哪里留下“到此一游”的痕迹,在基因中掀起怎样的“蝴蝶效应”。之所以说它自私,是因为无论它到哪里,都只在乎自身的完整性,不会管因为它的“插足”给基因带来怎么样的后果。
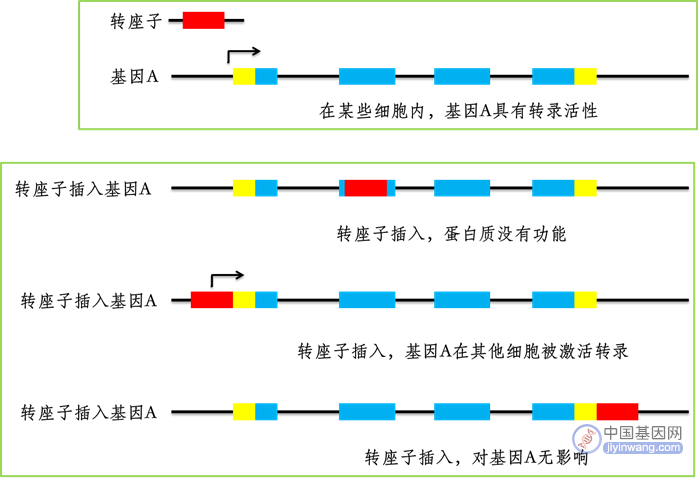
转座子插入基因及后果示意图
转座子可以分为两大类:DNA转座子和RNA转座子。其中,RNA转座子,也称为逆转录转座子(RE),是通过先转录成RNA,然后将RNA逆转录成DNA再插入到基因组中的一类转座子。
在人类基因组中,约50%是由重复的DNA序列组成。这种现象由逆转录转座子主导。近一半的人类核基因组是转座子衍生的,记录了数千年来各种类型的逆转录转座子的活性。这些序列中的绝大多数是不完整的或突变的,不再具有在基因组上移动和复制的潜力。但在进化时间尺度上相对较新的反转录转座子(Young REs)在基因组中仍然活跃,并且可能对基因组结构和功能产生影响。
为了传播到下一代,REs必须在种系或前种系细胞中进行转座。因此,人类早期胚胎中的转座活动并不令人惊讶。宿主进化到抑制转座元件,表明宿主和REs之间有持续的冲突,这与产生克隆内多样性和适应度变化的插入事件一致。
6月20日,德国柏林亥姆霍兹学会分子医学中心主导的国际联合研究小组在Plos Biology发表题为“A new human embryonic cell type associated with activity of young transposable elements allows definition of the inner cell mass”的研究成果。科学家通过对早期人类胚胎的基因活动数据进行研究,发现了一种被忽视的细胞类型,这种细胞在形成后的几天内会自我毁灭,作为一种质量控制过程来保护发育中的胎儿。这些发现揭示了受精后的生命最初阶段发生了什么,可能在未来有助于改进试管婴儿或再生医学治疗。

图3 研究成果(图源:[2])
科学家团队分析了5日龄胚胎每个细胞的基因活动数据,发现约四分之一的细胞与任何已知的细胞类型的特征不符。进一步的调查发现,这些细胞含有Young REs或“跳跃基因”,它们可以复制自身并重新插入到胚胎DNA中,在此过程中经常引起DNA损坏。单细胞数据显示,胚胎的关键细胞ICM表达一种名为人类内源性病毒H的基因,抑制ICM中的年轻跳跃基因。通过对胚胎进行染色,证实了这些细胞中存在来自跳跃基因的蛋白质,这些细胞的后代都有DNA损伤,并经历了程序性的细胞死亡过程。
这项研究的重要性在于揭示了胚胎发育早期质量控制的新机制。通过识别并清除携带错误基因的细胞,胚胎能够提高发育成功的机会,并避免潜在的发育缺陷。对于早期胚胎发育的理解产生了重要影响。通过发现这种质量控制机制和对跳跃基因的防御策略,有助于进一步研究人类基因组中其他有益的病毒或遗传元素,并探索它们在保护胚胎发育过程中的作用,未来可以更好地改进试管婴儿和再生医学治疗。
在试管婴儿过程中,胚胎的选择和筛选是至关重要的。了解质量控制机制可以帮助科学家更好地评估和选择最有潜力的胚胎进行移植,提高试管婴儿成功率。此外,对跳跃基因和其他遗传元素的防御机制的理解,可以为改善胚胎质量、减少遗传缺陷以及治疗某些遗传性疾病提供新的方法。
然而,这项研究还有一些局限性。研究使用了早期胚胎的基因活动数据,对于后续发育阶段和成熟的个体还需要更多的研究。此外,这项研究并没有直接解决试管婴儿或再生医学治疗中的具体问题,而是提供了新的研究方向和潜在的改进方法。需要进一步的研究来验证这些发现,并确定如何利用这些新发现来改善现有的生殖医学技术和治疗方法。这些研究结果还需要在更广泛的人群中进行验证,以确保其普遍适用性。此外,对于这些自我毁灭的胚胎细胞的详细机制仍需进一步研究。
跳跃基因领域专家Zsuzsanna Izsva?k博士表示:“人类和所有其他生物一样,与这些有害的跳跃基因进行着永无止境的斗争。虽然我们会尽一切可能抑制这些跳跃基因,但在发育的早期阶段,它们在一些细胞中仍然活跃,可能是因为胚胎无法及时建立起基因的防御机制。”
研究作者Laurence Hurst教授表示:“如果细胞受到跳跃基因等错误(如染色体数量过多或过少)的损害,那么胚胎会将这些细胞清除,不允许它们成为发育中胎儿的一部分。我们已经习惯了自然选择的偏爱。我们现在在胚胎中看到的也是适者生存,但这次是在几乎相同的细胞之间。我们发现了对抗这些有害遗传元素的新武器。”
参考文献:
[1]Radley A, Corujo-Simon E, Nichols J, et al. Entropy sorting of single-cell RNA sequencing data reveals the inner cell mass in the human pre-implantation embryo. Stem Cell Reports. 2023 Jan 10;18(1):47-63. doi: 10.1016/j.stemcr.2022.09.007. Epub 2022 Oct 13. PMID: 36240776; PMCID: PMC9859930.
[2]Singh M, Kondrashkina AM, Widmann TJ, et al. A new human embryonic cell type associated with activity of young transposable elements allows definition of the inner cell mass. PLoS Biol. 2023 Jun 20;21(6):e3002162. doi: 10.1371/journal.pbio.3002162. PMID: 37339119.
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。