Nature子刊:优化gRNA,创造出更安全的CRISPR基因编辑技术

CRISPR-Cas9基因编辑技术已经被广泛应用于通过研究感兴趣的基因,以及编辑疾病相关基因来进行基因治疗。在这项技术中,Cas9核酸酶与向导RNA(gRNA)一起被递送到细胞中,gRNA引导Cas9核酸酶到基因组中的特定位置。通过Cas9核酸酶切割基因组,造成DNA双链断裂,进而实现基因的敲除或添加。
然而,这一过程可能产生一些潜在副作用,包括导致不必要的基因突变和毒性。因此,需要一种新技术来减少CRISPR-Cas9基因编辑过程中的这些副作用,以提高其在工业和医学上的实用性。
2023年4月10日,日本九州大学和名古屋大学的研究人员在 Nature 子刊 Nature Biomedical Engineering 期刊发表了题为:Optimization of Cas9 activity through the addition of cytosine extensions to single-guide RNAs 的研究论文。
该研究开发了一种优化的CRISPR-Cas9基因编辑技术,能够极大地减少编辑过程中产生的突变,为更有效、更安全地治疗遗传疾病打开了大门。
具体来说,该研究发现,在传统gRNA的5'端添加胞嘧啶(C)延伸可以限制Cas9核酸酶的基因组编辑活性,提高CRISPR基因编辑的安全性和实用性。这种护卫gRNA(safeguard gRNA)策略还可以与Cas12a,以及CRISPRa和CRISPRi兼容。

对基因组进行编辑的一大阻碍是人们越来越担心突变和脱靶效应。这通常是由核酸酶靶向了与目标位点序列相似的基因组位点引起的。同样,当基因发生改变时,染色体水平的突变也会发生,这阻碍了癌症基因治疗的临床试验。而在去年,一位杜氏肌营养不良(DMD)患者在接受CRISPR-Cas9基因编辑治疗后死亡。
该论文的作者认为,目前使用的基于Cas9的基因编辑会导致对DNA的过度切割,从而导致一些突变的发生。
为了验证这一假设,研究团队在小鼠细胞中构建了一个等位基因特异性插入/缺失监测系统,简称“AIMS”,使用该系统分别评估了每条染色体上Cas9的活性。他们的结果表明,常用的Cas9基因编辑方法与非常高的编辑活性相关。他们确定这种高活性会导致一些不必要的副作用。
接下来,研究团队尝试通过对gRNA进行修饰来抑制过高的编辑活性,他们发现,gRNA的5'端额外的胞嘧啶延伸可以有效地作为过度编辑活性的“护卫”,并允许控制DNA切割。他们称这种微调系统为护卫gRNA(safeguard gRNA)。
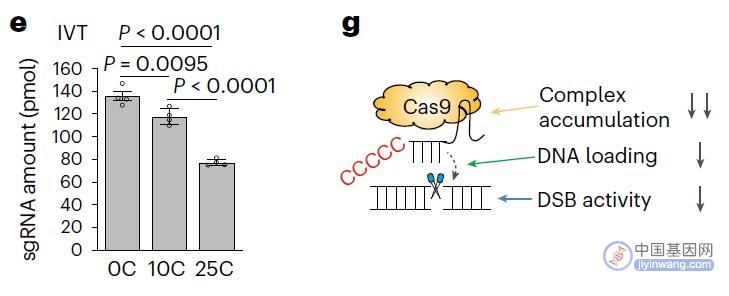
实现结果令人惊讶,使用这种新技术,在gRNA的5'端添加短的胞嘧啶扩展,减少了p53激活和对人类多能干细胞的细胞毒性,并在保持双等位基因编辑的同时增强同源定向修复,而较长的胞嘧啶扩展,进一步降低了靶向编辑活性,但提高了单等位基因编辑的特异性和准确性。
为了验证其在治疗的有效性,研究团队选择了一种罕见遗传疾病——进行性骨化性纤维发育不良(FOP)。研究团队使用该技术创造出了与人类FOP疾病相同的基因型的FOP小鼠模型。然后,使用FOP患者来源的iPS细胞,能够精确地修复损伤,特别是导致疾病的疾病相关等位基因中的单个碱基,这证明了该技术可作为一种安全有效的基因治疗方法。
研究团队还构建了第一个各种基因组编辑模式与Cas9活性之间相关性的数学模型,这将使用户能够在整个细胞群中模拟基因组编辑的结果。这一突破将使研究人员能够确定Cas9的活性,从而最大限度地提高效率,减少之前实验所需的巨大成本和人力。
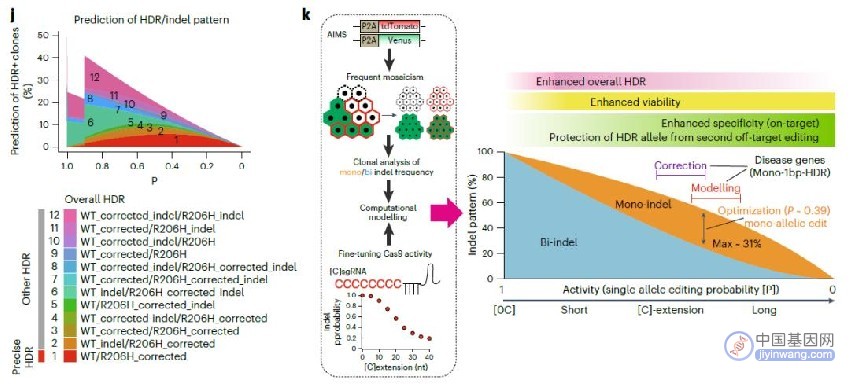
研究团队表示,这项研究建立了一个新的CRISPR基因组编辑平台,通过开发具有适当Cas9活性的活性调节护卫gRNA(safeguard gRNA),可以最大限度地提高所需的编辑效率。此外,该研究还发现,除了Cas9,护卫gRNA可以通过调节gRNA的活性来应用于各种需要gRNA的CRISPR工具,例如Cas12a。
对于使用Cas9激活或抑制感兴趣基因的技术,例如CRISPR激活(CRISPRa)和CRISPR干扰(CRISPRi),过度激活或抑制基因表达可能对细胞没有用处,甚至对细胞有害。通过护卫gRNA(safeguard gRNA)控制表达水平是一项重要的新技术,可用于各种应用,包括精确基因治疗。
据悉,研究团队目前正在启动商业计划,以推广这一新型CRISPR基因组编辑平台。研究团队表示,相信这项技术可以为医疗领域做出重大贡献,团队目前正在细胞和动物实验中评估其对目标疾病的治疗效果和安全性,并利用它来帮助开发治疗药物和基因治疗方法,特别是对于尚未建立治疗方法的罕见疾病。
论文链接:
https://www.nature.com/articles/s41551-023-01011-7
声明:本站所有文章资源内容,如无特殊说明或标注,均为采集网络资源。如若本站内容侵犯了原著者的合法权益,可联系本站删除。